יג וַיֹּאמֶר דָּוִד, אֶל-הַנַּעַר הַמַּגִּיד לוֹ, אֵי מִזֶּה, אָתָּה; וַיֹּאמֶר, בֶּן-אִישׁ גֵּר עֲמָלֵקִי אָנֹכִי. ....
טו וַיִּקְרָא דָוִד, לְאַחַד מֵהַנְּעָרִים, וַיֹּאמֶר, גַּשׁ פְּגַע-בּוֹ; וַיַּכֵּהוּ, וַיָּמֹת.
טו וַיִּקְרָא דָוִד, לְאַחַד מֵהַנְּעָרִים, וַיֹּאמֶר, גַּשׁ פְּגַע-בּוֹ; וַיַּכֵּהוּ, וַיָּמֹת.
בשנות החמישים של המאה ה-20 פענחו אנשי המדע את הבסיס המולקולרי להורשת התכונות של היצורים החיים על כדור-הארץ. מולקולת ה-DNA זוהתה כנושאת המידע, ומולקולות החלבונים כמבצעות התהליכים הכימיים של החיים. בשנות השישים זוהו מולקולות ה-RNA-שליח (mRNA) כמתווכות המעבירות מידע ליצירת חלבון מסוים מהגן המתאים במולקולת ה-DNA. המסלול הזה - על פי רצף ה-DNA משועתק mRNA, ועל פי רצף ה-mRNA מסונתז חלבון - כונה "הדוֹגמה המרכזית".
בשנים האחרונות התגלה שבתאים
איקריוטיים אכן קיים מנגנון לבקרת ביטוי של גנים המבוסס על RNA. על גילוי זה זכו אנדי פייר וקרייג מלו בפרס
נובל לפיזיולוגיה או רפואה לשנת 2006
עם השנים הוכנסו שינויים בדוֹגמה זו, אך התפישה הבסיסית, שלפיה הגנים המקודדים לחלבונים הם האחראים היחידים לפעולות החיים בתא, ברקמה וביצור השלם, שלטה עד סוף המאה ה-20. לאחר שהתבססה, בשנות השישים, הופנה מאמץ רב להבנת הבקרה על ביטוי הגנים הרבים והשונים בתא. הגנים בתא, כמו כלי נגינה בתזמורת, פועלים, כך נראה, תחת ניצוח מדויק להפליא, הקובע לא רק אם יהיו פעילים, אלא גם את עוצמת ביטוים. תזמורת הגנים, שכל אחד מהם פועל בזמן ובעוצמה מסוימים, מנגנת יחד את קונצרט החיים. אך מיהו המנצח של תזמורת הגנים? כיצד פועלת מערכת הבקרה הזאת?
בשנת 1969 פרסמו החוקרים רוי בריטן (Berriten) ואריק דוידסון (Davidson) מאמר תיאורטי שבו העלו את האפשרות, שמולקולת ה-RNA היא הבקר העיקרי של ביטוי גנים בתאים איקריוטיים. רעיון זה מקורו במחשבה, שהתאמת בסיסים בין ה-RNA המבקר לגן המבוקר היא דרך אלגנטית לזיהוי ספציפי של הגן הזה. ואולם, עם גילוי גורמי השעתוק - חלבונים המעודדים או מעכבים את היצמדות האנזים RNA פולימראז אל הקַדָם (Promoter), ובכך מבקרים את תהליך השעתוק - נזנח הרעיון שמולקולות RNA אחראיות לבקרת הביטוי של גנים.
נוכחות גן זר בגנום הפטוניה גרמה, בדרך
לא-ברורה, ל"השתקת" הביטוי של הגן המקורי התואם לו ברצפו
ברם, בשנים האחרונות התגלה שבתאים איקריוטיים אכן קיים מנגנון לבקרת ביטוי של גנים המבוסס על RNA, או ליתר דיוק, על מולקולות RNA זעירות (small RNAs). כיום מעריכים שלפחות כ-30% מהגנים באדם, ובכלל זה רבים מגורמי השעתוק, מבוקרים בדרך זו. למרבה הפלא, קיומו של מנגנון מרכזי זה נעלם מעיני המדענים עד לאחרונה. גילויו, גילוי שבעקבותיו זכו אנדי פייר (Fire) וקרייג מלו (Mello) בפרס נובל לפיזיולוגיה או רפואה לשנת 2006, מחולל בימים אלו מהפכה בהבנת הביולוגיה של היצורים בעלי הגרעין, והשלכותיו על הביוטכנולוגיה והרפואה הן כה רבות, שלא נוכל לתאר כאן אלא את החשובות שבהן.
להלן נתאר כיצד התגלה מנגנון בקרת הביטוי באמצעות מולקולות RNA זעירות, מהם רכיביו ותפקידיו וכיצד אפשר לנצלו לשימושים ביוטכנולוגיים.
השתקת גנים: מעורבות ה-RNA
בשנות השמונים של המאה ה-20 החלו מדענים ליצור צמחים מהונדסים גנטית, על-ידי החדרת גנים זרים לתוך המטען הגנטי של תאי צמחים. מתאים אלה
גידלו החוקרים תרביות, שמהן יצרו צמחים שלמים הנושאים ומבטאים את הגן הזר (הטרנסגן). בשנת 1990 ערכו החוקרת קרולין נפולי (Napoli) ועמיתיה ניסוי שנועד לברר במדויק את תפקידו של האנזים צ'לקון סינתאז (Chalcone synthase), המעורב בייצור פלבונואידים, צִבענים המקנים צבע סגול לעלי הכותרת של פרח הפטוניה (איור 1 משמאל). החוקרים יצרו צמחי פטוניה טרנסגניים, שהכילו עותקים נוספים של הגן המקודד לצ'לקון סינתאז בפטוניה. החוקרים ציפו לקבל פטוניות המייצרות יותר פלבונואידים, ולכן פרחיהן היו צפויים להיות בעלי צבע סגול עז יותר מפרחי המקור.
למרבה ההפתעה, קרה ההפך הגמור - חלק מהפטוניות הטרנסגניות, אף שהכילו עותקים נוספים של הגן המקודד לצ'לקון סינתאז, ביטאו את האנזים ברמות נמוכות יותר אף מצמח המקור, ולכן נשאו פרחים לבנים באופן חלקי או מלא (איור 1 מימין). מבדיקה לבירור הסיבה לרמות הצ'לקון סינתאז הנמוכות בפטוניות הטרנסגניות בעלות הפרחים הלבנים התברר שאף כי ה-mRNA של הגן המקורי והטרנסגן המקודדים לצ'לקון סינתאז משועתקים בגרעין התא כצפוי, מסיבה לא-ברורה אין הם מצטברים בציטופלזמה לרמות של צמח הפטוניה המקורי, ולכן אינם מתורגמים לרמה מספקת של האנזים צ'לקון סינתאז. רמה נמוכה זו של האנזים אינה מספיקה לייצור פלבונואידים שיקנו לפרחי הפטוניה צבע סגול כלשהו, ולכן הם לבנים. בניסוי המשך גילו החוקרים שהסיבה לרמה הנמוכה של ה-mRNA המקודד לצ'לקון סינתאז היא, שרובו מפורק במהירות עם מעברו מהגרעין לציטופלזמה.
החוקרים הסיקו מניסוי זה שנוכחות גן זר בגנום הפטוניה גרמה, בדרך לא-ברורה, ל"השתקת" הביטוי של הגן המקורי התואם לו ברצפו. החוקרים כינו את התופעה "דיכוי משותף" (co-suppression), מכיוון שביטוי הטרנסגן והגן המקורי התואם לו דוכאו בצמחים הטרנסגניים בעת ובעונה אחת. בתחילה סברו, שתופעת הדיכוי המשותף היא ייחודית לצמח הפטוניה. ואולם, כאשר נוצרו עוד ועוד צמחים טרנסגניים, התברר שתופעה זו מתרחשת במינים רבים של צמחים, ותמיד כתוצאה מביטוי של טרנסגנים בעלי רצף תואם לגן המושתק.

איור 1: יותר זה פחות. צמח הפטוניה שמימין מכיל עותקים נוספים (טרנסגנים) של הגן המקודד לאנזים צ'לקון סינתאז, האחראי לייצור צבען
סגול. להפתעת החוקרים, צבעם הסגול של הפרחים לא הוגבר בעקבות זאת, אלא דווקא נעלם. משמאל: צמח פטוניה מקורי לא-טרנסגני.
(Napoli C, Lemieux C, Jorgensen R. (1990), Introduction of a chimeric chalcone synthase gene into petunia results in reversible
co-suppression of homologous genes, in: trans. The Plant Cell 2: 279-289.)
בשנות השמונים פיתחו וירולוגים של צמחים טכנולוגיה חדישה ללוחמה בנגיפים התוקפים צמחים. השיטה, המבוססת על הנדסה גנטית, כללה החדרת גן של הנגיף התוקף אל המטען הגנטי של צמח. החדרת הגן נועדה להקנות לצמח עמידות בפני נגיף זה, ולעתים קרובות גם בפני נגיפים נוספים בעלי גנום תואם. לדוגמה: נמצא שביטוי גבוה בצמח של הגן המקודד לחלבון המעטפת של נגיף המוזאיקה של הטבק יכול להקנות לצמח עמידות בפני נגיף זה. ההשערה המקובלת היתה, שחלבון המעטפת שנוצר בעודף משבש את יכולת הנגיף התוקף להשלים את מחזור חייו. שיטה זו מכונה עמידות נגזרת מפתוגן (pathogen derived resistance).
ג'ון לינדבו (Lindbo) ועמיתיו חקרו בשנת 1992 את הבסיס המולקולרי לתופעת העמידות הנגזרת מפתוגן. לשם כך יצרו לינדבו ועמיתיו צמחים טרנסגניים המבטאים עותק נוסף של חלבון המעטפת של הנגיף Tobacco etch virus (TEV), נגיף שחומצת הגרעין שלו היא RNA חד-גדילי. לאחר יצירתם, הודבקו הצמחים הטרנסגניים בנגיף ה-TEV, כדי לבחון את עמידותם. החוקרים כללו בניסוי גם קבוצת ביקורת, שלצמחים שבה הוחדר במכוון עותק פגום של הגן לחלבון המעטפת, שאינו אמור להעניק עמידות על פי התיאוריה המקובלת. למרבה פליאתם, גילו החוקרים שחלק מצמחי הביקורת אף הם היו עמידים לנגיף ה-TEV. לאחר שהודבקו בנגיף ה-TEV, הראו חלק מצמחי הביקורת תסמיני מחלה אופייניים כגון עלים מקומטים (איור 2 מימין), אך לאחר זמן-מה, העלים החדשים שגדלו נראו חלקים ובריאים (איור 2 משמאל). בדיקה של הצמחים האלו העלתה שבעלים החדשים מצטבר ה-mRNA של הטרנסגן לרמה נמוכה בהרבה מהצפוי, ולא מצטבר כלל ה-RNA הנגיפי - ומכאן מראם הבריא. הדבקה של צמחים האלו בנגיף ה-TEV ובנגיפים צמחיים אחרים הראתה שצמחים אלו עמידים לנגיף ה-TEV, אך אינם עמידים לנגיפים אחרים, שהגנום שלהם אינו תואם ל-TEV. ממצאים אלו הובילו למסקנה, שנוכחות טרנסגן התואם ברצפו לגן מעטפת נגיפי שלם או חלקי מונעת (משתיקה) בדרך לא-ידועה את הצטברות ה-mRNA שלו ושל ה-RNA הנגיפי התואם לו, ובכך מקנה עמידות.
לאחר כמה ניסויים נוספים הציעו החוקרים מודל ראשוני, המנסה להסביר את תצפיותיהם. על פי המודל, בשלב הראשון מזוהה ה-mRNA של הטרנסגן השלם או הפגום, כנראה בגלל רמת שעתוקו הגבוהה בגרעין, על-ידי האנזים הצמחי RNA-dependent RNA polymerase (RDR), אשר מזרז בציטופלזמה את הפיכת ה-mRNA ממולקולה חד-גדילית למולקולה דו-גדילית. את המולקולה הדו-גדילית מזהה חלבון ציטופלזמי לא-ידוע, המעכל (מפרק) אותה למולקולות RNA זעירות. אלו מונעות בדרך לא-ידועה את הצטברות ה-mRNA של הטרנסגן וה-RNA הנגיפי התואמים להן בתא. מודל זה הצליח להסביר גם את תופעות הדיכוי המשותף ושיכוך פעולת הגנים, שבהן נוכחות עותקים טרנסגנים נוספים המשועתקים ברמה גבוהה בגרעין התא מונעת את הצטברות ה-mRNA שלהם ושל הגן המקורי התואם להם.

איור 2: חיסון אנטי-נגיפי. מימין: עותק שלם או חלקי של הגן המקודד לחלבון המעטפת של TEV הוחדר לטבק, וגרם להתאוששותו מההדבקה בנגיף
TEV (העלים החלקים, בחלקו העליון של הצמח). משמאל: צמח ביקורת שהודבק ב- TEVבאותו הזמן, ואין בו עותק של הגן המקודד לחלבון המעטפת של
TEV (עלים מקומטים).
(Lindbo J.A., Silva-Rosales L., Proebsting W.M., Dougherty W.G. (1993), Induction of a highly specific antiviral
state in transgenic plants: implications for regulation of gene expression and virus resistance. The Plant Cell 5: 1749-1759.)
על פי המודל של לינדבו, השתקת הגן
הושרתה עקב נוכחות RNA דו-גדילי שרצפו תואם לרצף הגן
כאשר נעשה שימוש בנגיפים מהונדסים לביטוי גנים שאינם תואמים ברצפם לגנים של הצמח המארח, התבטאו אלו, כצפוי, ברמה גבוהה ברוב חלקי הצמח. בניגוד לכך, כאשר בוטאו באמצעות אותם נגיפים גנים התואמים ברצפם לגנים של הצמח המארח, הסתבר שבמקום לקבל ביטוי-יתר של הגן המהונדס בצמח, מתרחשת דווקא השתקה של הגן המהונדס, יחד עם הגן הצמחי המקורי התואם לו. יש לציין שהנגיפים המהונדסים שבהם השתמשו החוקרים נושאים את המידע הגנטי שלהם במולקולת RNA חד-גדילית, ההופכת ל-RNA דו-גדילית במהלך התרבותם בתא הצמחי. מכאן שנגיף RNA מהונדס מייצר במהלך שכפולו בתא RNA דו-גדילי של הגן הצמחי שהוחדר לגנום שלו. ממצא זה תאם את המודל של לינדבו, שלפיו תופעת ההשתקה מושרית עקב נוכחות RNA דו-גדילי, שנוצר במקרה שלפנינו עקב שכפול ה-RNA של הנגיף המהונדס, ולא עקב פעילות האנזים הצמחי RDR.
השתקת גן צמחי על-ידי נגיף מהונדס כונתה "השתקה בעזרת נגיף" (Virus Induced Gene Silencing, VIGS) ואומצה במהירות כטכניקה מועדפת לחקר פעילותו של גן צמחי נתון על-ידי השתקתו בצמח (איור 3). לדוגמה: כאשר החדירו לנגיף את הגן המקודד לאנזים צלולוז סינתאז - האחראי ליצירת התאית שבדופן התא הצמחי - הושתק הגן של הצמח, ועלי הצמח הפכו מקומטים ורכים בהיעדר כמות מספקת של תאית בתאיהם.

איור 3: השתקה בעזרת נגיף: עלי הצמח שמימין (מסומנים בחץ) הודבקו בנגיף מהונדס הנושא את הגן הצמחי המקודד לאנזים פִיטוֹאֶן דֶסָטוּרָאז (phytoene desaturase, PDS). אנזים זה מעורב בייצור קרוטנואידים, שהם צבענים המשתתפים בין השאר בהגנת המנגנון הפוטוסינתטי מפני נזקי אור. לאחר ששוכפל הנגיף המהונדס בתאי העלים החדשים, הושתק בהם ה-PDS הצמחי וכתוצאה מכך הופסק ייצור הקרוטנואידים בצמח. בהיעדרם, נהרס המנגנון הפוטוסינתטי בנוכחות אור, והעלים הלבינו. בתמונה משמאל: צמח ביקורת שהודבק בנגיף לא-מהונדס, שאינו מכיל את הגן PDS.
להפתעת החוקרים התברר, שדווקא RNA דו-גדילי, שלכאורה אינו יכול ליצור זיווג בסיסים עם תעתיק המטרה, השתיק את הביטוי של גן המטרה ביעילות הגבוהה ביותר. עוד נמצא כי אפקט ההשתקה נגרם על-ידי הרס ה-mRNA התואם לו ולא בדרך אחרת (איור 4). למעשה יעילות ההשתקה היתה כה גבוהה, שהזרקה של מולקולות בודדות של RNA דו-גדילי הספיקה לגרום להרס כמות גדולה הרבה יותר של mRNA המטרה, ומכך הסיקו החוקרים שבמנגנון ההשתקה חייב להיות מעורב אנזים או אפקט הגברה כלשהו. עוד מצאו החוקרים שהשתקה של גן על-ידי ה-RNA הדו-גדילי מתאפשרת רק בתנאי ש-RNA זה תואם לחלקים מרצף הגן המצויים ב- mRNA, ואינה מתרחשת כאשר ה-RNA הדו-גדילי תואם לְאינְטרון או לקדם. כמו כן הדגימו החוקרים, כי ה-RNA הדו-גדילי גורם לייצור עותקים נוספים של עצמו, מתפשט לתאים נוספים ואף עובר לצאצאי התולעת המוזרקת. החוקרים כינו את התופעה RNA מפריע (RNA interference = RNAi. וראו מילון המונחים בסוף המאמר).
בניגוד לעדויות קודמות בצמחים ובפטריות לגבי מעורבותו של RNA דו-גדילי בהשתקה, הניסויים שערכו פייר, מלו ועמיתיהם הוכיחו באופן ישיר וחד-משמעי ש- RNAדו-גדילי הוא הגורם האחראי להשתקה, וסיפקו הסבר משכנע גם לתופעות ההשתקה השונות שתוארו עד אז רק בצמחים ובפטריות. מאוחר יותר, ניסויים רבים אחרים איששו את ממצאיהם של פייר ומלו, ואישרו כי RNA דו-גדילי הוא יעיל ביותר בהשתקת גן בעל רצף תואם לא רק בתולעים, אלא גם בפטריות, בצמחים, בזבובים, בדגים, בעכברים ואף בתאי אדם. שנה לאחר מכן בודד קרלו קוגוני (Cogoni) ועמיתיו מוטנט של עובש הלחם שאיבד את יכולת ההשתקה. החוקרים מצאו, כי הגן הפגום במוטנט זה, במצבו התקין, הוא המקודד לאנזים RDR, ההופך RNA חד-גדילי ל-RNA דו-גדילי. ניסוי זה אישש את המודל של לינדבו והוכיח כי האנזים RDR חיוני להשתקה בפטריות. בהמשך התברר, שגם בתולעים ובצמחים המצב דומה.
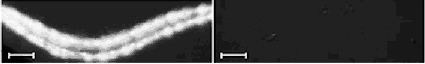
איור 4: RNAi. תולעת טרנסגנית המבטאת את הגן GFP זוהרת בדרך-כלל באור על-סגול כתוצאה מהצטברות חלבון ה-GFP. לתולעים דומות הוזרק RNA
דו-גדילי בעל רצף תואם לגן GFP (מימין) או רצף ביקורת שאיננו תואם (משמאל) והן הוארו באור על-סגול. ניתן לראות כי תולעת הביקורת ממשיכה
לזהור (משמאל, בלבן), ואילו בתולעת שהוזרק לה RNA דו-גדילי תואם GFP, ביטוי החלבון הזוהר הושתק לחלוטין ולכן אינה זוהרת (מימין).
(Fire A., Xu S., Montgomery M.K., Kostas S.A., Driver S.E., Mello C.C. (1998), Potent and specific genetic
interference by double-stranded RNA in Caenorhabditis elegans. Nature 391: 806-811).
מנגנון ההשתקה - RNA דו-גדילי, מולקולת RNA זעירות, RISC...
כאשר התברר שמולקולות RNA דו-גדילי, הנוצרות בין היתר על-ידי האנזים RDR או במהלך שכפול נגיף RNA, גורמות להשתקת גנים בעלי רצפים תואמים
לשלהן בתא, נפרצה הדרך לחקר הבסיס המולקולרי של תופעת ההשתקה. בשנת 1999 הצליחו אנדרו המילטון (Hamilton) ודוד באולקומב (Baulcombe)
לזהות מולקולות RNA זעירות (באורך 25-21 נוקליאוטידים) חד-גדיליות, ולקשור לראשונה את נוכחותן למנגנון ההשתקה בצמחים. החוקרים גילו כי
מולקולות ה-RNA הזעירות הן בעלות רצף המשלים לגן המושתק, ונמצאות רק בצמחים טרנסגניים שעברו דיכוי משותף או השתקה באמצעות נגיף. החוקרים
הסיקו כי למולקולות ה-RNA הזעירות תפקיד מרכזי בהשתקה בצמחים. החוקרים כינו את מולקולות ה-RNA הזעירות siRNAs
(small interfering RNA). תופעת ההשתקה באמצעות RNA או RNAi
התגלתה כתופעה כללית, המתקיימת באורגניזמים משמרים ועד בני-אדם
זמן קצר לאחר גילוי ה-siRNAs הראו גרג הנון (Hannon) ועמיתיו כי RNA דו-גדילי, שהוזרק לתאי זבובים במטרה להשרות השתקה, מפורק למולקולות RNA זעירות באורך 25 נוקליאוטידים. החוקרים מצאו כי אנזים המפרק RNA דו-גדילי מסוג RNAse III, שאותו כינו DICER, הוא האחראי לפירוק ה-RNA הדו-גדילי שהוזרק ל-siRNAs (איור 5). במחקר נוסף הצליחו החוקרים, בשיטות ביוכימיות, לבודד קומפלקס אנזימים שכונה RISC (RNA Induced Silencing Complex), הקושר את ה-siRNAs ומסוגל לחתוך RNA מטרה חד-גדיליים המשלימים להם ברצפם. הם מצאו שמולקולת ה-siRNA היא המכירה את RNA המטרה על בסיס השלמת רצף, ומנחה אליו את קומפלקס ה-RISC. רכיב מרכזי בקומפלקס ה-RISC הקושר את ה-siRNA הוא חלבון ממשפחת חלבוני הארגונאוט (AGO), שהיו ידועים כחיוניים להתפתחות תקינה בצמחים ובעלי-חיים. התברר שהגנים המקודדים ל-DICER ול-AGO שמורים היטב באבולוציה, ומהווים רכיבים מרכזיים במנגנון ההשתקה של בעלי-חיים, צמחים, פטריות ואף במין יחיד של שמרים - שמר החלוקה (Schizosaccharomyces pombe). תופעת ההשתקה באמצעות RNA או RNAi התגלתה, אם כן, כתופעה כללית, המתקיימת באורגניזמים משמרים ועד בני-אדם.
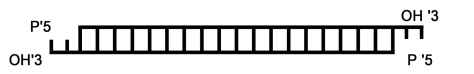
איור 5: תרשים מייצג של מולקולת siRNA דו-גדילית, שיוצר DICER מ-RNA דו-גדילי. המולקולה כוללת חלק מרכזי עיקרי של RNA דו-גדילי, שאורכו כ-19 נוקלאוטידים, שאליו נוספים כשני נוקלאוטידים בלתי מזווגים מכל צד בקצה ה-'3 של הגדיל. לאחר הקישור ל-RISC נותר הגדיל בעל הרצף המשלים בלבד.
לאחר יצירתם, ה-siRNAs משתלבים בקומפלקס ה-RISC, הכולל בתוכו את חלבון ה-AGO הקושר את ה- siRNAs. מיד לאחר הקישור, גדיל ה-siRNA הישיר מפורק, ונותר קשור רק גדיל ה-siRNA המשלים. זה מנחה את חלבון ה-AGO שבתוך קומפלקס ה-RISC לעבר RNA מטרה, שהוא RNA המשלים לו ברצפו. מבדיקת החלבון AGO התברר, כי אזורים בחלבון זה יוצרים חריץ אשר בו מזווגים ה-siRNA המשלים ו-RNA המטרה. לאחר זיווג הבסיסים בין ה-siRNA ל-RNA המטרה, נחתך RNA המטרה על-ידי AGO באזור התואם למרכז ה-siRNA. יש לציין כי קומפלקס ה-RISC המוטען ב-siRNA מתפקד כאנזים, המסוגל לחתוך מספר רב של מולקולות RNA מטרה לאחר שקשר מולקולת siRNA יחידה, בהתאמה להשערתם של פייר ועמיתיו לגבי האופי הקטליטי של התהליך. RNA המטרה המקוצץ מפורק בציטופלזמה על-ידי אנזימים נוספים, או משמש כתבנית לאנזים RDR לסינתיזה של RNA דו-גדילי המשמש כסובסטרט ל-DICER ליצירת siRNAs נוספים, המגבירים עוד יותר את תהליך ההשתקה (איור 6).
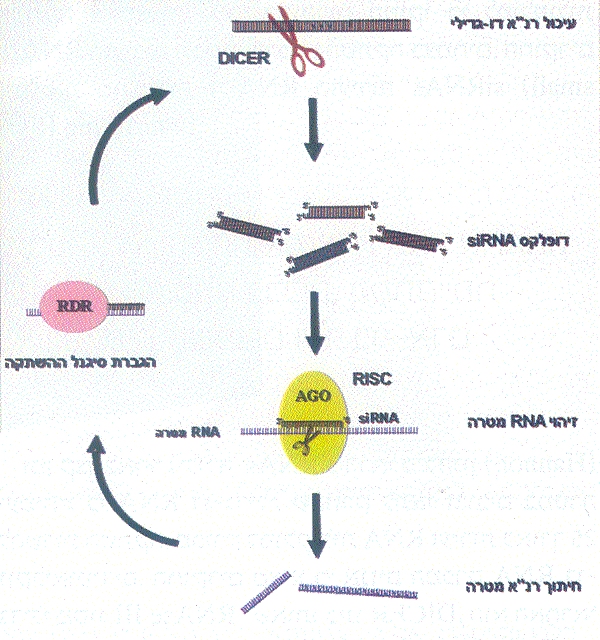
איור 6: הרכיבים והתהליכים המרכזיים המעורבים בהשתקה. עד כה זוהה האנזים RDR מפטריות, מצמחים ומתולעים
תפקידי מנגנון ה-RNAi
מיד לאחר גילוי מנגנון ההשתקה נשאלה השאלה: מהם תפקידיו בתא? הרי אין זה סביר שנוצר כדי להשתיק גנים כדי שמדענים יוכלו לחקור את פעילותם,
או במיוחד כדי לנטרל טרנסגנים. תשובה אחת לשאלה זו הגיעה מחקר הנגיפים הצמחיים. כאמור, רוב הנגיפים האלה נושאים את המידע הגנטי שלהם
במולקולת RNA חד-גדילי. בעת שכפולם בתא הצמח, החומר הגנטי של נגיפים אלה עובר שלב של RNA דו-גדילי. את ה-RNA הדו-גדילי הזה מזהה האנזים
הצמחי DICER ומעכל אותו ל-siRNAs, המשתלבים ב-RISC ומנחים אותו לחתוך את ה-RNA הנגיפי. בדרך זו נמנעת התפשטותו של הנגיף התוקף בצמח.
בצמחים, שאין בהם מערכת חיסונית המבוססת על נוגדנים, מנגנון זה משמש - כך אנו מבינים עתה - להגנה יעילה כנגד נגיפים. ייתכן שמנגנון ה-RNAi התפתח כמנגנון
פרימיטיבי להגנה מפני נגיפים זמן רב בטרם נוצרה מערכת החיסון מבוססת הנוגדנים בבעלי-חיים
אז איך בכל זאת קיימות מחלות נגיפיות רבות בצמחים? כמו בכל מירוץ חימוש, מתברר שבמהלך האבולוציה שלהם פיתחו רבים מהנגיפים המדביקים צמחים דרכים לעיכוב מנגנון ההשתקה, בעיקר על-ידי קשירת ה-siRNAs האנטי-נגיפיים הנוצרים בתהליך לחלבונים ייעודיים המקודדים בגנום שלהם. קישור זה מונע את ה-siRNA מלהשתלב בקומפלקס ה-RISC ואף לשמש כתחל ל-RDR, ובכך מקטין מאוד את האפקטיביות של ההשתקה האנטי-נגיפית. באחרונה התברר, שגם בתולעים ובזבובים מתפקד מנגנון ה-RNAi כמנגנון אנטי-נגיפי, והדבר אולי מרמז על כך, שמנגנון זה התפתח כמנגנון פרימיטיבי להגנה מפני נגיפים זמן רב בטרם נוצרה מערכת החיסון מבוססת הנוגדנים בבעלי-חיים.
אבל לא רק להגנה מפני נגיפים. טרנספוזונים (transposons), או גנים קופצים, הם רצפי DNA היכולים לקפוץ, בשיטת "חתוך והדבק", מאתר לאתר בתוך הגנום. תוך כדי כך הם עלולים לגרום למוטציות ולנזק לגנום. לכן חיוני לנטרל את פעילותם על מנת לשמור על שלמות הגנום, במיוחד בתאי המין, המעבירים את החומר הגנטי לדור הבא. התברר שמוטציות ברכיבים של מנגנון ההשתקה בתולעים ובצמחים הפכו טרנספוזונים שבדרך-כלל אינם פעילים לפעילים. נוסף על כך, שובטו מתולעים ומצמחים siRNAs שמקורם בטרנספוזונים, דבר המעיד שמנגנון ההשתקה פועל נגדם באופן טבעי. עוד התברר ש-siRNAs מסוגלים לעודד הוספת קבוצת מתיל ל-DNA עשיר בטרנספוזונים בגנום, וכך להפכו לאזור שאינו פעיל בשעתוק (לאמור - להטרוכרומטין).
שמר החלוקה Schizosaccharomyces pombe, האורגניזם הפרימיטיבי ביותר המוכר לנו כיום המצויד במנגנון ההשתקה, מנצל את יכולתם זו של ה-siRNAs לגרום למעבר של גנים ממצב פעיל בשעתוק להטרוכרומטין על מנת לגרום להיפרדות יעילה של הכרומוזומים לתאי-הצאצא במהלך חלוקתו. חוקרים גילו כי בשמר זה, siRNAs הנוצרים מ-RNA דו-גדילי המשועתק מרצפים באזור הצנטרומר מעודדים את הפיכת אזור הצנטרומר, מבנה בכרומוזום הממלא תפקיד חשוב בחלוקת התא, להטרוכרומטין. התברר שהטרוכרומטין באזור הצנטרומר חיוני לחלוקת תאי השמר, ותלוי בתקינותו של מנגנון ההשתקה. ראינו אם כן שלמנגנון ה-RNAi תפקיד חשוב בשמירה על שלמות הגנום מפני קטעי חומצות גרעין טפיליים, כדוגמת גנים זרים או טרנסגנים, נגיפים וטרנספוזונים. אך התפקיד החשוב ביותר של מנגנון זה עתיד היה להתגלות רק בהמשך.
מיקרו-RNA (micro-RNA) - "siRNAs" טבעיים המבקרים ביטוי של גנים אנדוגניים
על מנת ללמוד יותר על תכונותיו של האנזים DICER, פיתחו חוקרים שיטה לשיבוט וריצוף ה-siRNAs הנוצרים במהלך השתקה של טרנסגן בבעלי-חיים
וצמחים. להפתעתם של החוקרים, חלק מרצפי ה-siRNAs ששובטו כלל לא היו משלימים לרצף הטרנסגן שהושתק, אלא תאמו במדויק לאזורים שונים ברצף
גנום האורגניזם שממנו שובטו, אזורים שהיה ידוע שאינם משועתקים ל-mRNAs המקודדים לחלבונים. דוגמה לאזורים כאלה הם האינטרונים, שהנם רצפים
בתוך גנים המשועתקים ל-mRNA, אך נחתכים מתוכו ואינם מתורגמים לחלבון. ישנם גם אזורים אחרים ב-DNA שאינם מקודדים לחלבונים, ובעבר נחשבו
לאזורים שאינם עוברים שעתוק, וכונו בזלזול "DNA זבל". siRNAs "טבעיים" אלו, שנוצרו באורגניזם ללא קשר להשתקת טרנסגן, הובילו את החוקרים למסקנה שאינטרונים ו"DNA זבל" אכן מקודדים, אך לא לחלבון, בניגוד לדוֹגמה המרכזית, שלפיה כל גן המשועתק ל-mRNA מקודד לחלבון. התברר שאזורים שתאמו ל-siRNAs ה"טבעיים" אינם משועתקים ל-mRNA המקודד לחלבון, אלא משועתקים בנפרד ל-mRNA המקודד ל-RNA זעיר, הנוצר באופן טבעי ולא כתוצאה מתגובת RNAi המופנית כנגד RNA דו-גדילי שחדר לתא. לאחר ששועתק, מאמץ ה-mRNA הזה מבנה של RNA דו-גדילי דמוי סיכת ראש בעל זיווג לא-מושלם (איור 7). RNA דו-גדילי זה משמש כסובסטרט של האנזים DICER, המפרק אותו ל-RNA זעיר יחיד באורך של 21-24 נוקליאוטידים. את ה-RNA הזה כינו החוקרים micro RNA (miRNA) (איור 7).
miRNAs נוצרים, כאמור, בדרך שונה מ-siRNAs, אך הם בעלי מבנה זהה ל-siRNAs, ומנגנון פעולתם דומה. פירוש הדבר הוא, שלאחר יצירתו משתלב הדופלקס הדו-גדילי בקומפלקס ה-RISC, ולאחר הקישור לחלבון AGO משתחרר אחד הגדילים שלו (miRNA*), והגדיל השני (miRNA) מנחה אותו לנטרל mRNA בעל רצף משלים לשלו (איור 7). ואולם, בניגוד ל-siRNAs, המשתיקים RNA מטרה התואם לחלוטין ל-RNA שממנו נוצרו, miRNAs משתיקים mRNAs שונים, שאינם זהים להם לחלוטין. בצמחים הדמיון בין mRNAs המטרה ל-miRNA המבקרים אותם גבוה יחסית, והשתקת ה-mRNAs נעשית על-ידי חיתוך, כמו ב-RNAi. בבעלי-חיים, הדמיון בין mRNAs המטרה ל-miRNA המבקרים אותם הוא בדרך-כלל נמוך יחסית, והשתקתם נעשית בדרך של עיכוב תרגום ולא באמצעות חיתוך (איור 7).

איור 7: הרכיבים והתהליכים המרכזיים המעורבים בהשתקה טבעית המבוססת על miRNA
תפקידיהם של רוב ה-miRNAs אינם ידועים עדיין, אך חיזויים ממוחשבים של mRNA המטרה התואמים את רצף ה-miRNA הידועים באדם מעריכים כי לפחות כ-30% מה-mRNAs המקודדים לחלבונים באדם מבוקרים על-ידי miRNA כלשהו. מחקרים ראשוניים מאשרים כי בקרת הביטוי על-ידי miRNAs היא גורם הכרחי להתפתחות התקינה של בעלי-חיים וצמחים, ופגיעה בבקרה זו גורמת לפגיעה קשה בהתפתחות האורגניזם ואף למוות. בין היתר, מתברר כי miRNAs בבעלי-חיים מבקרים גנים המעורבים בבקרה על עיתוי התפתחות העובר, התמיינות תאי גזע, בקרת גדילה ועוד.
בדומה ל-siRNAs, miRNAs מעורבים גם בהגנה כנגד נגיפים. אם בעבר היה מקובל לחשוב שהגורם העיקרי לסרטן הוא מוטציות בגנים המקודדים לחלבונים מסוימים (כגון דכאנֵי גידול ואונקוגנים), הרי שעתה ברור שגם פגיעה ב-miRNA מסוים יכולה להוביל למחלת סרטן. בצמחים, רוב הגנים המבוקרים על-ידי miRNAs הם גורמי שעתוק המעורבים בבקרת תהליכים מכריעים בהתפתחות הצמח, כדוגמת התפתחות העלה, התמיינות הפרח, בקרת מועד הפריחה, תגובה להורמונים וכן תגובה לעקות סביבתיות שונות. לאור המידע הזה אפשר לומר בביטחון, ש- miRNAs הם בקרי-על של ביטוי, לצד גורמי השעתוק, בצמחים ובבעלי-חיים. בקרים אלו משקפים את תפקידו החשוב ביותר של מנגנון ה-RNAi, כמנגנון מרכזי של בקרת ביטוי באורגניזם. הרי זה מדהים, שעד לפני שנים אחדות כלל לא היה ידוע קיומו של מנגנון חשוב זה.
מנגנון ההשתקה בשירות הביוטכנולוגיה
גילוי מנגנון ה-RNAi אִפשר לראשונה להשתיק את הביטוי של גן מסוים, שחלק קטן מרצף הבסיסים שלו ידוע, באופן יעיל וספציפי. שיטה זו האיצה את
חקר התפקוד של גנים ממגוון רחב של יצורים איקריוטיים - בעיתוי מצוין, שכן הפרויקטים הרבים לקביעת רצפי הגנום של יצורים שונים חשפו מספר
רב של גנים שתפקידם אינו ידוע. השימוש במנגנון ההשתקה לפגיעה בביטוי גנים מסוימים, אם ביצור השלם ואם בחלק מתאיו, מספק מידע על תפקודי
גנים בדרך השלילה. דהיינו, אילו תפקודים נפגעים כאשר מושתק גן זה או אחר. לצורך מחקרים אלה פיתחו המדענים טכניקות שונות לביטוי siRNAs שישתיקו גן מטרה בתא. לדוגמה: על-ידי ביטוי RNA דו-גדילי הזהה לגן המטרה, שיפורק על-ידי DICER ל-siRNAs; על-ידי ביטוי mRNA המתקפל לסיכת ראש ומעוכל על-ידי DICER ל-miRNA; בבעלי-חיים התברר שאפשר להשתיק גן גם באופן ישיר, על-ידי החדרת siRNAs דו-גדיליים, שסונתזו במעבדה, ישירות לתאים. אלו משתלבים ב-RISC ומנחים אותו לחיתוך RNA המטרה.
מדענים צופים שבעתיד נוכל לרפא את
רוב המחלות הנגיפיות בצמחים באמצעות siRNAs אנטי-נגיפיים
אבל לא רק המחקר הטהור הרוויח. היכולת להשתיק גן מטרה באופן ספציפי עוררה התלהבות ותקווה גם לשימושים ביוטכנולוגיים ורפואיים. אחת הדוגמאות הטובות היא יצירת צמחים עמידים לנגיפים. מחלות נגיפיות בצמחים גורמות לנזקים עצומים בגידולים חקלאיים, שבחלקם פוגעים כמה נגיפים שונים. עד היום, רוב הפתרונות התבססו על מניעה מחד גיסא ועל השבחה על-ידי דורות של הכלאות עם זנים עמידים מאידך גיסא. לעומת זאת, בניסויי השתקה שנערכו התברר כי החדרה לצמח של טרנסגן המקודד ל-RNA דו-גדילי התואם לרצף הגנום של נגיף צמחי יחיד, או אף לכמה גנומים מנגיפים שונים, מעוררת בצמח יצירת siRNAs אנטי-נגיפיים, ומקנה לצמח עמידות מוחלטת כנגד הנגיפים הרלוונטיים. לאור זאת מדענים צופים שבעתיד הלא-רחוק, נוכל לרפא את רוב המחלות הנגיפיות בצמחים.
דוגמה חשובה אחרת הן תרופות המבוססות על siRNAs לטיפול במחלות באדם. מחלות רבות באדם, כסרטן ואלצהיימר, נובעות מייצור שגוי של חלבון זה או אחר. מסתבר שלהשתקת גנים על-ידי siRNAs יש יתרונות רבים על פני שיטות מקובלות לעיכוב חלבונים מזיקים, כדוגמת עירוי נוגדנים או בליעת מעכבים. בין יתר יתרונותיהם, siRNAs הם זולים לייצור, ספציפיים ביותר, אינם רעילים, בעלי השפעה מתמשכת ובעלי יכולת השתקה חזקה בריכוזים נמוכים.
החסרונות העיקריים של siRNAs כתרופה, לעומת טיפולים קיימים, הם חוסר יציבותם בדם והקושי להחדירם לרקמת המטרה. גישה אחת לפתרון הבעיה היא שימוש בנגיפים מהונדסים, שכבר פותחו לצורך ריפוי גני, על מנת לייצר את ה-siRNAs ברקמת המטרה. גישה נוספת היא שימוש בשינויים כימיים של בסיסי ה-siRNAs, המשפרים את יציבותם וחדירותם. לדוגמה, שיגור מולקולות ה-siRNAs אל תוך התאים כשהן עטופות בשכבת מגן שומנית, המאפשרת איחוי עם ממברנות (קרומיות) התאים והעברת התכולה אל תוך התא.
חרף הקשיים הטכניים, העובדה שמולקולות קטנות של RNA יכולות לשבש באופן ספציפי ביטוי גנים בגוף, ולהקל על חולה מבלי לפגוע ב-DNA שלו-עצמו, מעודדת כיום מדענים רבים בעולם לפתח טיפולים למחלות שונות באמצעות siRNAs. בין היתר התברר, שאפשר להשתמש באופן יעיל ב-siRNAs לנטרול פעילותם של נגיפי מחלה כדוגמת נגיף האיידס ונגיף צהבת מסוג B בתאים שהודבקו. לגבי נגיף צהבת מסוג B, נוטרלו נגיפים מדביקים לא רק בתרביות תאים, אלא אף באורגניזמים שלמים - בעכברים.
ניסויים בהשתקה של גנים אונקוגניים (מחוללי סרטן) בתאי סרטן הצליחו בכמה מקרים לעצור את ביטוים, ולפגוע ביכולת הפלישה וההתחלקות של התאים. כאשר החדירו לעין siRNAs כנגד VEGF - חלבון המעורב בהופעת מחלת העיניים Macular degeneration, שהיא הגורם מספר אחת לעיוורון בחברה המערבית - הצליחו לבטל, בבעלי-חיים, את התפתחות כלי הדם החדשים הלא-תקינים בעין, הגורמים להופעת המחלה. גם נטרול ציטוקינים הקשורים להופעת אסתמה הראה תוצאות חיוביות ביותר.
לאור הצלחות אלו ואחרות, נערכים בימים אלה ניסויים קליניים ראשונים בכמה תרופות המבוססות על siRNAs. החוקרים מקווים, שעם שיפור היציבות וההחדרה של מולקולות ה-siRNAs, יהיה זה אפשרי להחדיר לגוף את הכמויות הנדרשות כדי לקבל את ההשפעה המבוקשת ברקמה המתאימה.
מקורות:
- Bartel D.P. (2004), MicroRNAs: genomics, biogenesis, mechanism, and function. Cell 116: 281-97.
- Baulcombe D. (2004), RNA silencing in plants. Nature 431: 356-63.
- Fire A., Xu S., Montgomery M.K., Kostas S.A., Driver S.E., Mello C.C. (1998), Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature 391: 806-811.
- Hamilton A.J., Baulcombe D.C. (1999), A species of small antisense RNA in post-transcriptional gene silencing in plants. Science 286: 950-952.
- Dykxhoorn D.M., Lieberman J. (2006), Running Interference: Prospects and Obstacles to Using Small Interfering RNAs as Small Molecule Drugs. Annual Review of Biomedical Engineering.
מילון מונחים
- RNAi (RNA מפריע): מנגנון תאי טבעי לבקרה של ביטוי גנים, שבו נוכחות של RNA דו-גדילי מסוגלת לגרום להפחתה ניכרת של ביטוי RNA הומולוגי.
- DICER: אנזים מפרק RNA מסוג RNase III, המזרז פירוק של RNA דו-גדילי למולקולות RNA זעירות (20-24 נוקליאוטידים (דו-גדיליות, קרי siRNAs או miRNAs.
- siRNAs: מולקולות RNA זעירות דו-גדיליות, המיוצרות על-ידי DICER מ- RNAדו-גדילי ארוך (המסונתז בדרך-כלל על-ידי RDR) ופועלות להשתקת RNA מטרה הזהה ברצפו ל- RNA שממנו נוצרו.
- miRNAs: מולקולות RNA זעירות המקודדות בגנום ומשמשות כבקרי שעתוק במגוון יצורים איקריוטיים. miRNAs דומים ל-siRNAs במבנה ובדרך הפעולה, אך שונים מ-siRNAs בכך שהם נוצרים מ-RNA ארוך המתקפל לצורת סיכת ראש לא-מושלמת, ובכך ש-RNA המטרה שלהם אינו זהה ברצפו ל-RNA שממנו נוצרו.
- RISC: קומפלקס אנזימים הכולל בתוכו את חלבון ה-AGO, המסוגל לקשור RNA זעיר המנחה אותו, על פי זיווג בסיסים, ל-RNA מטרה, שאותו הוא חותך בדיוק במרכז האזור המזווג.