ד"ר איתן ראובני. מליוני יונים בשנייה
חלק ניכר מהאנרגיה שאנו מפיקים בתאי גופנו משמש לשמירת "יכולת ההגדרה העצמית" של התאים החיים המרכיבים את הגוף, כלומר, להגדרת הגבולות שבין תוכם של התאים החיים לבין סביבתם החיצונית,זו שמעברו החיצוני של קרום התא.למטרה זו מקפידים התאים על שיעורי ההפרשים שבין ריכוזיהם של חומרים שונים משני עברי קרום התא. לדוגמה, הם מקפידים שריכוז הנתרן שמחוץ לתא יהיה תמיד גבוה מריכוז הנתרן שבתוכם. בדרך כלל, ריכוז החומרים בתוך התא נמוך מזה שמחוצה לו. יוצא מהכלל הזה הוא, למשל, האשלגן, שריכוזו בתוך התא רב מריכוזו בתווך הבין-תאי. הבדל נוסף בין פנים התא למרווח הבין-תאי מתבטא בכך, שצדו הפנימי של קרום התא טעון במטען חשמלי שלילי,ואילו צדו החיצוני טעון מטען חשמלי חיובי. המתח שנוצר משני עברי קרום התא בשל הפרשי הריכוזים והמטענים החשמליים האלה יוצר "מפלי אנרגיה", שהם המקור העיקרי לאנרגיה הזמינה לתפקוד התא ולהזנת תהליכי החיים השונים.
בסך הכל קיימים פחות מעשרה יונים המשתתפים באופן קבוע במשחק הזה של שינוי הריכוזים. החשובים והנפוצים שבהם הם נתרן, סידן, אשלגן, וכלוריד. החומרים המעטים האלה מאפשרים לתא לבצע רפרטואר גדול מאוד של תגובות ופעולות. שאלה: כיצד מפלי אנרגיה מעטים כל כך יוצרים כמה אלפי תגובות תאיות שונות? תשובה: התגובות התאיות נוצרות כתוצאה ממערכות תקשורת שבאמצעותן מתבצעות תגובות גומלין רבות ושונות בין החומרים שמצויים מחוץ לתא, לבין אלה שמצויים בתוכו . למעשה, קיימות שתי מערכות תקשורת כאלה. המערכת היותר ידועה היא זו המבוססת על קולטנים חלבוניים המוצגים על קרום התא, ושאליהם נקשרים "שליחים כימיים" שונים המגיעים מחוץ לתא. מערכת התקשורת השנייה, הפחות ידועה, מבוססת על "תעלות יוניות". גם ה"תעלה" היא, למעשה, מולקולה חלבונית הממוקמת על קרום התא, שקצה האחד בולט מצדו החיצוני של קרום התא, ואילו הקצה האחר נמצא בתוך התא. מדובר במעין צינור,שבתנאים מסוימים עשוי לאפשר מעבר של יונים שונים מתוך התא החוצה, או בכיוון ההפוך: מהמרווח הבין-תאי אל תוך התא, פנימה. רוב התעלות מותאמות למעבר סוג אחד של יונים בלבד.
התעלות עשויות ליצור תקשורת בין-תאית מיידית. דוגמה בולטת לתופעה הזאת מתחוללת בלב, שמיליוני התאים המרכיבים אותו מתכווצים ומתרפים בעת ובעונה אחת, לפי אות מוסכם. פקודות ההתכווצות וההרפיה, והשמירה על אחידות הקצב שלפעולת התאים השונים, נתונה לאחריות ה"תעלות". הפרשי המתח והריכוז שולטים בתעלות, ומהווים גם את המקור העיקרי לאותות החשמליים והכימיים המועברים במערכת העצבים. היכולת לזהות ולהבין את הכללים השולטים בפעולתן של התעלות עשויה לפיכך לתרום רבות להבנת מנגנוני החיים הבסיסיים ביותר, ולהקנות יכולת לבצע מניפולציות והתערבויות טיפוליות רפואיות שונות. ד"ר איתן ראובני, מהמחלקה לכימיה ביולוגית במכון ויצמן למדע, ממקד את מחקריו בהבנת מנגנוני הפתיחה, הסגירה והמוליכות שלתעלות המעבירות יוני אשלגן.
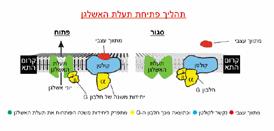
כאשר משתנה המבנה שיוצרות ארבע יחידות המשנה המרכיבות את פתח התעלה, התעלה נפתחת. כאן נכנס לפעולה מרכיב נוסף של התעלה, שמזהה וקושר יוני אשלגן בלבד. כך הוא מסנן את יוני האשלגן מתוך התמיסה הבין-תאית, ומאפשר אך ורק ליונים האלה להיכנס לתעלה ולעבור דרכה. תהליך הסינון מתבצע במהירות עצומה: מיליוני יונים מזוהים וממשיכים בדרכם דרך התעלה מדי שנייה. אבל כיצד פועל המנגנון הפותח את התעלה ומאפשר לכמות גדולה כל כך של יונים לעבור בה? אילו חלקים של התעלה אחראים למנגנונים אלו? כדי לענות על השאלות הללו משלב ד"ר איתן ראובני שיטות של הנדסה גנטית עם טכנולוגיה המאפשרת למדוד ולבחון פעילות של תעלה בודדת אחת. שיטה זו, שפותחה על ידי ברט זקמן וארווין נהר ממכוני מקס פלנק בגרמניה, ואשר זיכתה אותם בפרס נובל לרפואה לשנה 1991,מבוססת על שימוש בצינוריות זכוכית מיקרוסקופיות שקוטר פיהן כאלפית המילימטר. באמצעות הצינוריות שואבים המדענים ולוכדים קטע זעיר מקרום התא שעליו מצויה תעלה אחת בלבד. בשלב זה הם יכולים לבצע מדידות של הזרם הזעיר שנוצר כתוצאה ממעבר היונים בתוך התעלה.
ד"ר ראובני התמקד, כאמור, בתעלות אשלגן הנפתחות כתוצאה מקשירה של מולקולות תוך-תאיות (חלבוני G), המופעלות על ידי קולטנים הממוקמים בקרום התא,והקושרים מולקולות של מתווך עצבי (נוירוטרנסמיטר) מסוים. חלבוני G מורכבים משלוש תת-יחידות משנה: אלפא,ביתא וגאמה. כך, קשירת מולקולת המתווך העצבי לקולטן גורמת להתפרקות חלבון ה-G כאשר יחידת האלפא נפרדת מיחידת הביתא והגאמה הנותרות קשורות זו לזו. מבנה זה של שתי היחידות ביתא וגאמה הוא האחראי להפעלת התעלה. אבל מה בדיוק קורה מהשלב שבו נקשרות יחידות הביתא והגאמה לתעלה ועד לפתיחתה? כדי לענות על השאלה הזאת החליט ד"ר ראובני לבחון מרכיבים תת-מולקולריים של התעלה, ואת התפקיד המדויק שכל אחד מהם ממלא בתהליכי פתיחת התעלה וסגירתה. ד"ר ראובני ותלמידי המחקר רונה סדג'ה, קרין סמדג'ה ונוגה אלג'ם פיתחו מערכת המאפשרת לסרוק ביעילות עשרות אלפי מוטציות גנטיות של תעלת האשלגן,הנפתחות כתוצאה מפירוק חלבוני ה-G. בדרך זו זיהו החוקרים חומצות אמיניות בודדות המשמשות כ"מפתח" לפתיחת התעלה.
כך התברר, שהמפתח לפתיחת תעלת האשלגן נמצא באזור ייחודי של התעלה, בחלק שמקיים קשרי גומלין חזקים עם קרום התא. בהמשך התברר שה"מפתחות" האחראיים לפתיחת התעלה ממלאים תפקיד חשוב נוסף, בייצוב התעלה כשהיא פתוחה. הבנה בסיסית זו של מנגנוני פתיחת תעלת האשלגן וסגירתה עשויה לקדם את הבנת המנגנונים השולטים בתעלות יוניות נוספות, דבר שעשוי לאפשר - בעתיד-את פיתוחן של דרכים ושיטות חדשות לביצוע טיפולים רפואיים מדויקים במגוון מחלות,החל מהפרעות בסדירות קצב הלב וכלה בחיזוק או החלשת תקשורת עצבית במוח.