כיצד חוקרים בקטריופאגים?
כל הנגיפים קטנים מכדי להיראות במיקרוסקופי האור הטובים ביותר (מלבד יוצאי דופן ספורים, כנגיף האבעבועות השחורות וקרוביו). אפשר לראותם
רק במיקרוסקופ אלקטרונים. רוב הווירולוגים אינם משתמשים במיקרוסקופ אלקטרונים לצורך עבודתם השוטפת - הם מתבוננים במוקדים (plaques)
של נגיפים על מרבדים צפופים של תאים או חיידקים, ומשתמשים בתכולתם של מוקדים אלה.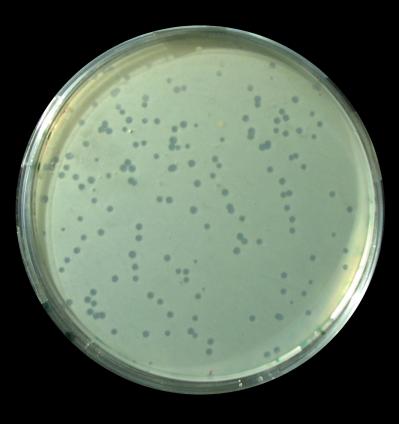
מוקדים צלולים של בקטריופאג λ בתרבית חיידקי
Escherichia coli
©ד"ר דרור בר-ניר
המבנה הבסיסי של נגיפי החיידקים דומה לנגיפים האנימליים - חומר תורשתי, RNA או DNA העטוף במעטפת חלבונית. אך בעוד שמרבית הנגיפים האנימליים עטופים בממברנה ליפידית (שמקורה בתא המאכסן) ולכן הם מכונים נגיפים עטופים, רובם המכריע של נגיפי החיידקים (מלבד משפחה אחת - Cystoviridae) אינו עטוף בממברנה כזו, ולכן הם מכונים נגיפים ערומים. גודלם של מרבית נגיפי החיידקים הוא בין 20 ל-200 ננומטר.
הבקטריופאגים נצמדים לחיידקי המטרה שלהם באמצעות צמדנים (adhesins), המתקשרים לקולטנים (receptors) ייחודיים במעטפת החיידק. אחר-כך הם חודרים לתוכם בשלמותם או בחלקם (כפי שיתואר בהמשך), משעבדים את מערכות החיידק לייצור המרכיבים של צאצאיהם, והצאצאים פורצים החוצה, לרוב על-ידי פיצוץ (lysis) של תאי החיידקים, אך לעיתים גם על ידי חירור מעטפת החיידק (והחיידק "מחלים" וממשיך בחייו כרגיל). מחזור חיים נגיפי זה מכונה ליטי (lytic).
הבקטריופאג כמזרק לחומר התורשתי
הבקטריופאגים חייבים להתגבר על בעיה מיוחדת, שאין לנגיפים האנימליים: תאי מרבית החיידקים מוקפים בדופן קשיחה, שאינה מאפשרת את חדירתם.
חלק מהם מצוידים במבנה מיוחד: לקופסית החלבונית העוטפת את החומר התורשתי של הנגיף מחובר צינור חלול, העטוף בזנב חלבוני שיכול
להתכווץ. לאחר היצמדות הנגיף לקולטן שבמעטפת החיידק, מתכווץ הזנב החלבוני ומחדיר את הצינור, כמו מחט של מזרק, דרך הדופן והממברנה אל
תוך תא החיידק. אז, מועבר החומר התורשתי (שיכול להיות DNA או RNA) של הנגיף לתוך החיידק ואילו המעטפת החלבונית של הנגיף נשארת מחוץ
לתא.ומה קורה לאחר חדירת החומר התורשתי? אם מדובר ב-DNA, חלקים מה-DNA מתועתקים מיד ל-RNA המתורגם לחלבוני המעטפת של הנגיף, תוך שימוש במערכות האנזימיות של החיידק המאכסן. בד בבד מוכפל ה-DNA הנגיפי, לעתים במאות עותקים. בתוך דקות אחדות מתמלא התא החיידקי בעשרות עד מאות בקטריופאגים. החיידק מתפוצץ, וכל הבקטריופאגים מתפרצים החוצה ו"מחפשים" להם קרבנות חדשים.
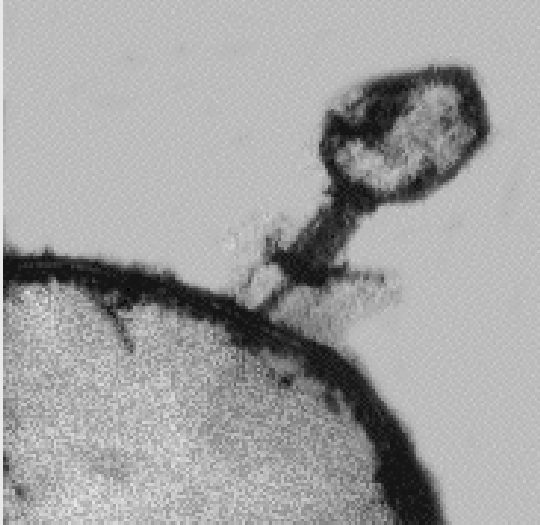
בקטריופאג על "טרפו". צילום במיקרוסקופ אלקטרונים.
By kind
permission of Dr. Elizabeth Kutter, The Evergreen State College, Olympia, Washington
התרומה הנגיפית לאלימות החיידקית
לחלק מהבקטריופאגים, המכונים מתונים (temperate phages), שלב נוסף, אלטרנטיבי, במחזור החיים - ליזוגני (lysogenic), בו מתמזג החומר
התורשתי שלהם (המכונה קדם-נגיף או prophage) בחומר התורשתי של החיידק המאכסן ומתקיים כחלק ממנו במשך דורות רבים ורק אז, לרוב בתנאים של
עקה, חורג ממנו, נוצרים צאצאים המפוצצים את החיידק המאכסן ויוצאים "לחפש" מאכסן חדש. מסתבר שנגיפים אלה, במצב הפרופאג, נושאים עמם לעתים גנים הבאים לידי ביטוי בחיידק הליזוגני. גנים אלה מקנים את היכולת לגרום מחלות: רעלני חיידקים שמקורם בגנים נגיפיים מקנים ל-Clostridium botulinum את היכולת לגרום לבוטוליזם ולחיידק Corynebacterium diphtheriae את היכולת לגרום לקרמת (דיפטריה). גם לחיידק Streptococcus pyogenes, הגורם לדלקת הגרון ולפעמים גם למחלות חמורות יותר, מתווסף לעתים פרופאג המקודד לרעלן הגורם לפריחה האופיינית של מחלת השנית (סקרלטינה). גם דיזנטריה נגרמת על-ידי זנים מכילי פרופאגים מקודדי רעלנים של E. coli ו-Shigella. צמדנים חלבוניים שמקורם בפרופאגים מאפשרים ל-Streptoccoccus mitis (המוכר לנו כגורם העששת) להצמד לטסיות הדם ובאמצעותן להגיע לקרום הלב ולגרום שם לדלקת. ליכולת החדירה לתאים של זני Salmonella אחראית מערכת העברה שמקורה בפרופאג.
בחיידקים מסויימים, הפרופאגים מהווים חלק משמעותי (20-10 אחוז) מהגנום. הזן הפתוגני של E. coli, O157:H7, למשל, מכיל 18 פרופאגים שונים, המהווים כ-16 אחוז מהגנום.
זיהוי חיידקים באמצעות בקטריופאגים
כיום מוכרים בקטריופאגים רבים, שמרביתם ייחודיים למאכסן, ואפילו לזנים מסוימים של אותו מאכסן, ורק מיעוטם יכולים להדביק מאכסנים ממינים
שונים. הייחודיות של ההדבקה מאפשרת למעבדות, המחזיקות מגוון רב של בקטריופאגים, לזהות ולהבדיל בין הזנים השונים המעורבים במגפות ובהתפרצויות של מחלות חיידקיות.
קצת היסטוריה
ארנסט הנקין (Ernest Hankin), בקטריולוג אנגלי שפעל בהודו, היה הראשון ש"חשד" בקיומם של בקטריופאגים. בשנת 1896, הוא כתב על גורם
מסתורי במימי נהרות הגנגס והג'ומנה, הגורם להיעלמות חיידקי הכולרה (Vibrio cholerae) מהתרביות שחקר. הנקין הסיק שלא
מדובר בחיידקים, כיוון שסינן את המים במסננים מתאימים. גם הבקטריולוג הרוסי ניקולאי גמליה (Nikolay Fedorovich Gamaleya),
דיווח ב-1898 על תופעה דומה בחיידקי Bacillus subtilis. כעשרים שנה חלפו, במהלכם נוספו דיווחים נוספים שלא היה להם המשך, ואז (ב-1915), הצליח לראשונה החוקר הבריטי פרדריק טווֹרְט (Frederick William Twort) לבודד את אותם גורמים מסתוריים, היכולים לעבור דרך מסננים המונעים מעבר חיידקים (כלומר קטנים מ-200 ננומטר), היוצרים מוקדים צלולים על מרבד של חיידקים בצלחת. אך את המחקר המשמעותי הראשוני בתחום ביצע הבקטריולוג הקנדי-צרפתי פליקס דְהֵרל (Felix d'Herelle).
ההתקלות הראשונה של דהרל בנושא היתה עוד בשנת 1910, במקסיקו, כשחקר מחלה קטלנית של ארבה, והבחין בהופעת מוקדים צלולים על מרבדי החיידקים שבודד מהחרקים. אך רק ב-1915, במכון פסטר בפריז, כשניסה לפתח חיסון כנגד חיידקי Shigella שגרמו לדיזנטריה בקרב החיילים הצרפתים (מגיפת Maisons-Laffitte בפרברי פריז) - במלחמת העולם הראשונה ושב ונתקל בתופעה, הבין דהרל שלפניו נגיפים התוקפים חיידקים. הוא פרסם את תגליתו ב-1917 והוא זה שהמציא להם את השם "בקטריופאגים" - אוכלי החיידקים (פאגוס ביוונית פירושו "אוכל"), וטבע את השם "מוקדים" (plaques) לאזורים הנקיים מחיידקים.
טיפול נגיפי במחלות חיידקיות
דהרל היה הראשון שניסה, ואף הצליח, להשתמש בבקטריופאגים כאמצעי לטיפול במחלות חיידקיות. דהרל ועמיתיו טיפלו בהצלחה בתרחיפים של נגיפים
בטיפוס העופות (avian typhosis, הנגרם על ידי Salmonella gallinarum), ובדיזנטריה חיידקית בארנבות. את הצלחתו יישם
בשנת 1919 בבית החולים בפריס, ביחד עם פרופ' ויקטור הוטינל (Victor-Henri Hutinel) בטיפול בחולי דיזנטריה אנושיים. את תרחיף
הנגיפים המיועד לחולים, שאותו הכינו על-ידי הוספת תכולתו של מוקד צלול למבחנה ובה תרחיף של חיידקים גדלים, הם שתו קודם בעצמם, כדי
לוודא את בטיחותו, לפני שנתנו אותו לילד בן 12 שהיה במצב חמור. התסמינים של הילד הוקלו מיד לאחר הטיפול (היחיד) והילד החלים תוך מספר
ימים. דהרל והוטינל חזרו על הטיפול בהצלחה עם שלושה חולים נוספים. דהרל לא הזדרז לפרסם את הישגיו וכך ריצ'רד ברוינוף (Bruynoghe) וג'וזף מייסין (Maisin) הקדימו אותו ופרסמו על טיפול נגיפי בבני אדם ב-1921: הם הצליחו בטיפול בזיהומי עור של סטפילוקוקים, בעיקר בפצעי ניתוחים, על ידי הזרקת תרחיפים של נגיפים באזורי הזיהום. בשנות ה-20' וה-30' הצטרפו חוקרים אחרים לתחום ופרסמו הצלחות נוספות. בין השנים 1935-1930, הצליח הרופא הצבאי הבריטי J. Morison, על-ידי שימוש בנגיפים מתאימים, להוריד בצורה משמעותית את התמותה מכולרה באזור Naogaon שבהודו.
דהרל המשיך בניסוייו והצליחו לטפל באמצעות נגיפים באלפי חולי כולרה ודֶבר בהודו. הוא פתח מעבדה מסחרית בפריס שייצרה חמישה תכשירים נגיפיים: Bacte-coli-phage, Bacte-rhino-phage, Bacte-intesti-phage, Bacte-pyo-phage, ו-Bacte-staphy-phage, ששווקו מאוחר יותר על ידי החברה שלימים הפכה לחברת לוריאל (L'Oreal).
במקביל, התפתח התחום גם בארצות הברית, שם נמכרו על ידי חברת אלי-לילי (Eli Lilly) שבעה תכשירים מסחריים של בקטריופאגים: Colo-lysate, Ento-lysate, Neiso-lysate, Staphylo-lysate, Colo-jel, Ento-jel, ו- Staphylo-jel. - שיועדו לפעול כנגד סטפילוקוקים, סטרפטוקוקים, E. coli וחיידקים נוספים - במורסות (abscesses) פצעים מוגלתיים, זיהומיים חיידקיים של הנרתיק, מחלות בדרכי הנשימה ובאוזניים.
מחלוקות לגבי היעילות של התכשירים הנגיפיים והופעת החומרים האנטיביוטיים, בסוף שנות ה-40, עצרו את התפתחות התחום במדינות "המערב". במקביל החלו להשתמש בבקטריופאגים ככלי מחקר עיקריים בביולוגיה המולקולרית, שדהרל נחשב לאחד ממייסדיה.
בברית-המועצות, בצאצאיה המדיניים ובמדינות מזרח אירופה המשיכו לפתח ולהשתמש בבקטריופאגים לריפוי מחלות - בשילוב עם טיפולים אנטיביוטיים ובלעדיהם. שני מכונים הובילו את המחקר בתחום הטיפול באדם: מכון אליאבה בטיבילסי שבגאורגיה ומכון הירצפלד בוורוצלב (Wroclaw) שבפולין.
מכון אליאבה (Eliava Institute of Bacteriophage, Microbiology, and Virology) נוסד ב-1923 על-ידי הבקטריולוג גאורגי אליאבה (Georgyi Eliava). הקשר של המכון עם דהרל נוצר ב-1926 ואז החלו לחקור שם את הבקטריופאגים. דהרל פעל שם מספר חודשים ואף התכוון להשתקע בו. אך ב-1937 נאסר אליאבה על-ידי משטרו של סטאלין, והוצא להורג. למרות זאת, הצליח המכון להוביל את המחקר בתחום ובשיאו העסיק כ-1,200 עובדים, שייצרו כמויות אדירות של תכשירים נגיפיים כנגד תריסר גורמי מחלות.
במכון הירצפלד (Hirszfeld Institute of Immunology and Experimental Therapy), שנוסד ב-1952 בוורצלב (Wroclaw) שבפולין, החלו לחקור את הבקטריופאגים מ-1957. שם פתחו תרחיפי בקטריופאגים לטיפולים בחיידקים הגורמים לאלח-דם, מחלות בדרכי הנשימה ובדרכי השתן, בזיהומים של פצעי ניתוחים ועוד... מאמץ מיוחד הושקע באיתור נגיפים כנגד חיידקים עמידים לחומרים אנטיביוטיים רבים.
היום, כשסוף עידן האנטיביוטיקה נראה באופק ומחפשים לה תחליפים, החל גם "המערב" לשוב לאופציה הנגיפית. יתרון משמעותי של האופציה הנגיפית על האופציה האנטיביוטית (הדועכת) הוא בכך שהפגיעה הנגיפית היא ייחודית ואפשר לכוונה לחיידק הפתוגני בלבד, בעוד שהחומרים האנטיביוטיים פוגעים גם בחיידקי הפלורה הטבעית, שלהם חשיבות רבה לבריאות המטופל. פגיעה בחיידקים אלה עשויה לגרום למחלות חיידקיות משניות, למשל דלקת המעיים החמורה (pseudomembranous colitis) שגורם החיידק Clostridium difficile, המשגשג בעקבות הפגיעה בפלורת החיידקים התקינה של המעיים כתוצאה מטיפולים אנטיביוטיים (פניצילינים, צפלוספורינים וקלינדמיצין) במחלות אחרות.
יתרון חשוב של הטיפול בבקטריופאגים: כאשר מתפתחת עמידות של חיידקי המטרה כלפי הנגיף (בדרך-כלל כתוצאה ממוטציה בחלבון המעטפת המשמש קולטן לנגיף), אפשר לאתר בזמן קצר יחסית נגיף אחר, או מוטנט של אותו הנגיף, שיקטלו את החיידק. מציאת אנטיביוטיקה חדשה היא תהליך ממושך ויקר יותר.
יש גם חסרונות לשימוש בבקטריופאגים: קיים קושי לפגוע בחיידקים שהם טפילים תוך-תאיים, למשל הכלמידיות והריקֶציות. מכיוון שחיידקים אלה נמצאים בתוך תאי המארח, לא ברור עדיין איך יצליחו להביא את הבקטריופאגים עד אליהם. בנוסף, המערכת החיסונית של המאכסן זוכרת את הבקטריופאג ואינה מאפשרת את פעילותו אחרי הפעם הראשונה.
פרופ' בקה סולומון מאוניברסיטת תל-אביב אף הצליחה לרתום את הבקטריופאגים לטיפול במחלה שאינה נגרמת על-ידי חיידקים - מחלת האלצהיימר. אך על כך, בהזדמנות אחרת.
לסיכום: בקטריופאגים הם "גורמי מחלות" קטלניים בחיידקים, שלרוב גורמים למותם. לקראת סוף העידן האנטיביוטי, מסתמן שבקטריופאגים יחליפו את החומרים האנטיביוטיים כטיפול בחולים במחלות חיידקיות. לנגיפים במצב "רדום" יש תרומה גנטית משמעותית לחיידק המאכסן ויש שהם מקנים לו תכונות חדשות, התורמות ליכולתו לגרום מחלה.
קישורים
מאמרים מסכמים בנושא הריפוי באמצעות בקטריופאגים:
1. A. Sulakvelidze, Z. Alavidze and J.G. Morris (2001), Bacteriophage Therapy, Antimicrobial
Agents and Chemotherapy 45(3): 649-659.
2. W.C. Summers (2001), Bacteriophage Therapy, Annual Review of Microbiology, Vol. 55: 437-451
3. ש. מ. ששא (2004), הטיפול בבקטריופאגים בזיהום מחיידקים, "הרפואה" 143, 121-125.2. W.C. Summers (2001), Bacteriophage Therapy, Annual Review of Microbiology, Vol. 55: 437-451