זה כמה שנים עוסקים המדענים בפענוח התהליך הפיזיולוגי של מות התאים המתוכנן, המכונה אפופטוזיס (אפופטוזיס - ביוונית קלאסית: נשירה. תאים מתים וניתקים מהגוף בדומה לנשירת העלים מהעץ בעונת השלכת, או בניתוק עלי הכותרת מהפרח.). על אף שעדיין אין תשובות לשאלות רבות הנוגעות לתהליך, ברור היום כי הוא נתון לבקרה גנטית-מולקולרית שנשמרה במהלך האבולוציה מהפטריות, התולעים ועד לאדם. עד היום נאסף מידע רב על אודות ה"מוציאים לפועל" של תהליך האפופטוזיס, ועל מנגנון הבקרה שלו; ידועים גם "כלי הנשק" המשתתפים בביצוע המשימה, ומוכרים הגורמים שמונעים את הביצוע או מעכבים אותו.
מוות מתוכנן של תאים קשור למחלות גנטיות ולמחלות נרכשות. אחת המחלות היא מחלת הסרטן. כאשר חל עיכוב בתהליך מוות התאים המתוכנן כתוצאה מליקוי בבקרה שלו, חלה ירידה במספר התאים המתאבדים ומתפתחים גידולים סרטניים. גם מחלות דלקתיות כרוניות (כגון קצרת וטרשת העורקים) ומחלות אוטואימוניות, שבהן מערכת החיסון של הגוף הורסת רקמות עצמיות (כגון דלקת פרקים ראומטואידית), קשורות לתהליכים אפופטוטיים. ליקויים בבקרת תהליך ההתאבדות, הגורמים להאצתו ולעלייה במספר התאים המתאבדים, תורמים להתפתחותן ולהחמרתן של מחלות ניווניות של תאי עצב במוח (במחלות אלצהיימר ופרקינסון למשל) ; לכשל חיסוני נרכש (איידס) ; לאירועי שבץ במוח ובלב ולמקרים מסוימים של נזקי כליה וכבד.
נמק ומוות מתוכנן
לא כל מוות של תאים בגוף נעשה בתהליך האפופטוזיס; מוות של תאים יכול להתרחש גם בתהליך של נמק (נקרוזיס). בנמק, התא הוא קרבן פסיבי - הוא ניזוק בעטיים של שינויים שחלים בו או בסביבתו, למשל מחסור בחמצן. באמצעות תצפיות מיקרוסקופיות אפשר להבחין בין תאים שמתים בעקבות מוות מתוכנן לבין תאים המתים מנמק. נזק נמקי מונע את התא מלאזן את משק הנוזלים שבו ואת שיווי המשקל האוסמוטי שלו. במצב זה מים ויונים חודרים אל תוך התא, פוגעים באברונים חיוניים, והתא מתנפח כמו בלון. מות תאים כתוצאה מנמק הוא תהליך דלקתי, ובסופו תאים של מערכת החיסון בולעים את התא הנפגע - פעולה שעשויה להזיק לתאים בריאים הנמצאים בקרבת מקום.
בניגוד לנמק, בתהליך המוות המתוכנן התא הוא קרבן פעיל המבזבז אנרגיה למטרת חיסולו. התא אינו מתנפח כי אם מתכווץ דווקא, ומתנתק מהתאים השכנים. במהלך האפופטוזיס נמצא התא כבעין מצב של "רתיחה": שלפוחיות מבצבצות ומבעבעות על פניו, לעתים נעלמות ובמקומן מופיעות שלפוחיות חדשות. האברונים הפנימיים של התא שומרים על צורתם, למעט הגרעין - הוא משתנה באורח דרמתי. השינוי הבולט ביותר מתרחש בדנ"א ובחלבוני הגרעין. הם נדחסים יחד לתוך בועות בסמוך למעטפת הגרעין. בשלב זה התא הגוסס נבלע בתאים סמוכים או בתאים "מסלקי אשפה" (scavengers) המשוטטים ברקמות. מוות מתוכנן אינו מלווה בתהליך דלקתי, ותהליך ההרג מתבצע בצורה נקיה ביותר - התאים הגוססים נבלעים במהירות עוד בטרם נוצרו תוצרי פירוק רעילים. לעתים התאים האפופטוטיים עוברים שינויים נוספים לפני שהם נבלעים: גרעין התא ניתק, והתא עצמו מתחלק לכמה גופים שמכילים חלקיקי גרעין, גם הם מורחקים בידי "מסלקי האשפה". 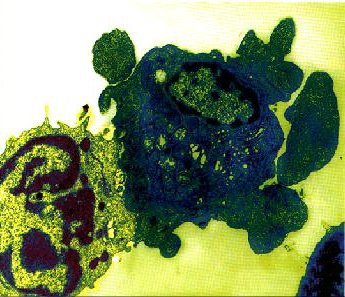 |
"נשיקת המוות" = תא הרג צמוד לתא מטרה וגורם לו לעבור תהליך אפופטוזיס. צילום אלקטרון-מיקרוגרף ע"י ד"ר דליה רוזן ממכון וייצמן (צביעה מלאכותית) |
שכרה של התאבדות
למות תאים מתוכנן נודעת חשיבות רבה בהתפתחות העוברית. כבר במחצית הראשונה של המאה ה-20 הכירו חוקרים בעובדה כי תמותת תאים בתהליך פעיל הכרחית להמשך ההתפתחות. בשנת 1950 הוכח כי מות תאים מתוכנן מראש מכוון התפתחות נאותה של יצורים רב-תאיים, למן השלב העוברי ועד לשלב הבוגר. התפתחות זו, המושגת באמצעות סילוק חזוי ומתוכנן של איברים, ומתבצעת בהרחקת אוכלוסיות תאים שנדונו למוות במהלך ההתפתחות. שתי דוגמאות דרמתיות לכך הן ראשן הצפרדע, שבמהלך גלגולו ליצור בוגר מאבד את זנבו, והתולעת העגולה Caenorhabditis elegans . התולעת, המכילה כ-1090 תאים ואורכה מילימטר אחד, מגיעה לבגרות לאחר שהיא מאבדת 131 תאים בדיוק, ואפילו זוהו הגנים המשתתפים במות תאים מתוכנן זה. גם במהלך ההתפתחות של עובר האדם, תאים עוברים מוות מתוכנן. העובר האנושי ברחם אמו מאבד במהלך התפתחותו את הקרומים המחברים את פרקי אצבעותיו אלה לאלה. במהלך ההתפתחות העוברית מתים כ-80% ואף יותר מתאי העצב שבמערכת העצבים המרכזית.
מדוע נהרסים תאי עצב כה רבים במוח במהלך התפתחות העובר? חוקרים סבורים כי הסיבה לכך היא ההתאמה הנדרשת בין מספרם של תאי העצב למספר תאי המטרה הקולטים את המסרים העצביים. כל תא מטרה מקבל עצבוב מתא עצב, וכל עודף של תאי עצב הוא מיותר. גדילתם של תאי העצב והתפתחותם תלויות בנוכחות חומרים מסוימים הקרויים "גורמי גדילה עצביים". ייתכן שחיסרון בהם גורם לכך שלא כל תאי העצב שנוצרו יוותרו בחיים, ואותם תאים שאינם זוכים לכמויות מתאימות של גורמי הגדילה העצביים מתים בתהליך אפופטוטי. לא ברור מדוע היצור החי משמיד לקראת התבגרותו תאים עודפים שיצר במהלך התפתחותו העוברית. ייתכן שאין בגוף, בשלבי ההתפתחות המוקדמים, מידע באשר למספר התאים המדויק שלהם יזדקק כבוגר. לפיכך, במסגרת ההתפתחות התקינה נוצרים בשלב הראשון תאים עודפים, ובשלב השני "מתוקן" המספר באמצעות "פקודות התאבדות", תיקון שמוביל לצורתו הסופית של היצור החי.
חשיבותו של המוות המתוכנן מראש ביצור הבוגר זכתה להכרה 20 שנה לאחר מכן. בשנת 1972 פרסמו הפתולוג האוסטרלי ג'והן קר (Kerr) ועמיתיו הסקוטים אנדרו ווילו (Wyllue) ואלייסטר קארי (Currie) מחקר, ובו טענו כי מוות תאים מתוכנן מראש מתקיים גם לאחר ההתבגרות, ונמשך לאורך כל מהלך החיים. ליקוי בהפעלתו או בעיכובו של התהליך תורם להתפתחות מחלת הסרטן. למעשה, כך אמרו, בכל רקמות הגוף נמצאים תאים המועדים למוות מתוכנן, ביניהם תאים במעי, בבלוטת התימוס, ברחם, וכן תאים שנדבקו בנגיף או תאים הרגישים לשינויים גנטיים (ראו תיבה).
תאים מתאבדים בבוגר
ברוב רקמות הגוף מצויים תאים המועדים להתאבדות בשלב זה או אחר בחייהם, נזכיר כאן כמה רקמות בגוף המכילות תאים מתאבדים. עין: עדשת העין, המתהווה במהלך ההתפתחות העוברית, מורכבת מתאים מתאבדים שמתמלאים בחלבון קריסטלין. מעי: בבסיס השלוחות של רירית המעי נוצרים תאים שנודדים במשך כמה ימים לקצה השלוחות. הם מתים מוות מתוכנן, ונושרים מהרקמה. עור: תאי העור מתחילים את חייהם בשכבות עמוקות מתחת לעור, נודדים אל עבר פניי העור, במהלך נדידתם הם עוברים אפופטוזיס, ומצטברים על פני העור כשכבת מגן. תימוס: לימפוציטים מסוג T - תאים הממלאים תפקידי מפתח במערכת החיסון, מתבגרים בתימוס, במהלך התבגרותם הם עוברים "סינון" בתהליך של מוות תאים מתוכנן, שבמהלכו מתים אותם תאים המגיבים עם מרכיבי גוף עצמיים. רחם: תאי רירית הרחם מתים בתהליך אפופטוטי בכל חדש בעת הוסת. תאים אחרים: תאים שתפקידם נפגע בשל מוטציה גנטית מתאבדים. אלה שהצליחו לחמוק מתהליך ההתאבדות עלולים להתרבות וליצור גדולים סרטניים. |  |
מנגנון ההוצאה לפועל
העיתוי שבו מתרחשת התאבדות התאים, האותות המעוררים אותה ומהלך הביצוע, את כל אלה חוקרות היום באורח נמרץ קבוצות מחקר רבות ברחבי העולם. מקובל להבחין בתהליך התאבדות התאים בשלושה שלבים: שלב העירור, שלב "פסק הדין" או קבלת ההחלטה, ושלב ההוצאה לפועל (ראו איור 1). שלב העירור: רבים ושונים הם הגורמים ה"לוחצים על ההדק" - אלה המעוררים את מנגנון ההרג. ביניהם נכללים גורמים המסבים נזק לתא, כגון קרינה מייננת, הדבקה בנגיפים, חוסר בגורמי גדילה ונוכחות או חוסר בהורמונים שונים. גורמים אלה יכולים לפעול מתוך התא או מחוצה לו. הם מפעילים חלבונים מתווכים שאחראים על העברת המסר האפופטוטי. לעתים העיתוי צפוי מראש. כך אצל התאים צוברי הקרטין (קרטינוציטים) הנודדים אל השכבה החיצונית של העור ומתים 21 יום לאחר תחילת נדידתם. מותם מוחש כתוצאה מכוויית שמש - אז הם מתים עוד בטרם הגיעם אל השכבות החיצוניות של העור.
שלב פסק הדין: ההחלטה על פסק הדין נעשית באמצעות חומרים ייחודיים האחראים להעברת המסר האפופטוטי, המפעילים קולטני התאבדות בתאים. חומרים אלה יכולים להפעיל התאבדות וגם למנוע אותה.
שלב ההוצאה לפועל: המסר האופופטוטי עובר לחלבונים מיוחדים המוציאים לפועל את החיסול העצמי. בתוכם נכללת משפחה מיוחדת של אנזימים המיוצרים בכל תא ותא ומכונים קספאזות. היום ידועים עשרה אנזימים כאלה. אפשר לתאר אותם כעין סכינים חדים המאוחסנים בנדנם במצב מנוחה. כשתא מתפקד כראוי ומועיל לגוף, תהליך ההתאבדות משותק, והתא אינו מאפשר ל"אנזימי סכין" אלו לפעול. אך כשהתא מותקף על ידי גורם מזהם או הופך לממאיר ומסכן את הגוף, נשלפים אותם חלבונים קטלניים מנדנם ומתחילים לרסק את חלבוני התא האחרים; תשתיות התא נהרסות ועמן נפגע גם החומר התורשתי, והתא נכחד. בעת האחרונה זוהו אצל יונקים חלבונים נוספים המשתייכים לקבוצה זו של אנזימים.

במהלך האפופטוזיס התא עובר שינויים ניכרים. תחילה הוא מתכווץ ומתנתק משכניו (למעלה). בהמשך הוא עובר למצב "רתיחה" ושלפוחיות מבעבעות על פניו (למטה). דנ"א וחלבוני הגרעין נדחסים לתוך בועות בסמוך למעטפת הגרעין, והתא והגרעין נשברים ונבלעים על-ידי תאים בסביבה (צביעה מלאכותית).

האבולוציה מקנה לתאים מטיפוסים שונים רגישות שונה לאפופטוזיס. הדבר מתבטא בכך שתאים שאינם מתחלקים אינם נוטים לחסל את עצמם במהירות. דוגמה לכך הם תאי העצב שיכולת התחדשותם ביצור הבוגר מוגבלת ומוות שלהם הוא סכנה קיומית, ולכן הם מתקיימים כמעט לכל אורך חיי היצור החי. בניגוד לכך, תאים הניתנים להחלפה בקלות רבה ומותם אינו מאיים על קיום הגוף, מועדים להתאבדות. דוגמאות לכך הם תאי הדם ותאי מערכת הרבייה.
בעת האחרונה התברר כי רגישות תאים לאפופטוזיס קשורה לפעילותו של חלבון ששמו Bcl2 וחלבונים דומים נוספים. כמה מהם מעכבים התאבדות תאים, וכמה מהם מחישים את התהליך. שיווי המשקל בין רמות החלבונים המעכבים לבין המזרזים קובע את האופן שבו יגיב התא למאותתי תהליך המוות המתוכנן מראש.
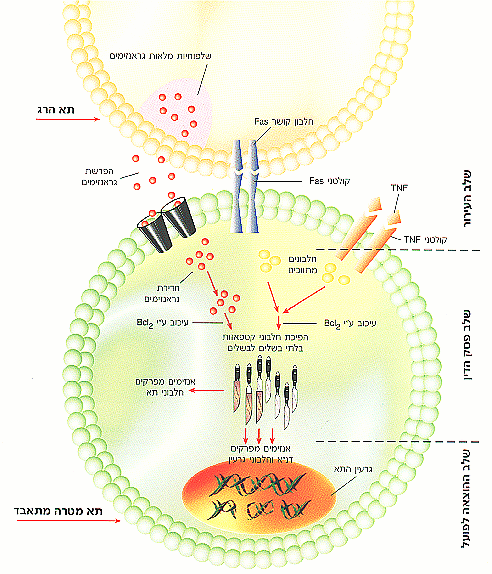
איור 1 - "נשיקת המוות": תהליך ההוצאה לפועל של גזר דין המוות הנגזר על תא מטרה ע"י תאי הרג במערכת החיסון. תא ההרג יכול לעורר אפופטוזיס ולגרום להתאבדותו של תא המטרה בשלושה אופנים: האחד ע" הפרשת חלבון מסיס הנקרא TNF (Tumor Necrosis Factor) הנקשר לקולטנים מיוחדים (קולטני TNF) על תא המטרה. התהליך השני מופעל ע"י חלבונים קושרי Fas המצויים בתא ההרג ונקשרים לקולטני Fas בתא המטרה. לאחר קישור TNF ו-Fas לקולטניהם, מופעלים תהליכים תוך תאיים שבמהלכם נשלפים חלבוני הקספאזות הבלתי פעילים מנדנם ומפעילים תהליכי פירוק חלבונים בתא ובגרעין, פירוק דנ"א וחלבוני הגרעין. התהליך השלישי מתווך ע"י שחרור שלפוחיות (וזיקולות) מלאות חומרים הנקראים גראנזימים אל מחוץ לתא ההרג. החלבונים האלו חודרים את מעטפת תא המטרה ופועלים ישירות על מעגל הקספאזות. חלבונים מיוחדים פועלים בעיכוב התאבדות התא. אחד מהם הוא החלבון Bcl2, כאשר עולה כמותו, הקספאזות לא מופעלות ותהליך האפופטוזיס מתעכב.
חיסול במערכת החיסון
לימפוציטים מטיפוס T (תאי-T) הם הזרוע הראשית של מערכת החיסון. אלה הם תאים הנלחמים בפולשים זרים. תאי-T עוברים סינון מוקדם, שבמהלכו רבים מהם מתאבדים בתהליך אפופטוטי, והתאבדות זו חשובה לשם פעילות חיסונית תקינה. תא-T שיגיב נגד מרכיבי הגוף עצמו יגרום לשורה של מחלות אוטואימוניות ולהרס רקמות נורמליות. בעקבות תהליך הסינון, רק תאי-T בוגרים המכילים קולטני השמדה נגד פולשים זרים יעברו אל זרם הדם, ויתפקדו כסיירת הבטיחות של הגוף. תהליך הסינון נעשה בבלוטת התימוס, שם מושמדים תאי-T המבטאים קולטנים נגד מרכיבים עצמיים. ההרג נעשה בתהליך של התאבדות. מנגנון הסינון רגיש ומתואם באופן עדין במיוחד, והבקרה עליו נעשית על פי עוצמת הקישור שבין הקולטן הייחודי של התא לבין חלבונים עצמיים שנמצאים על שטח הפנים של תאי התימוס. באופן זה מורחקים תאי-T בעלי יכולת היצמדות חזקה מדי, שעלולה לגרום בעתיד להרס של תאים בריאים. בנסיבות מסוימות עשוי להתאבד גם תא-T בוגר בשל היותו רגיש לגורמים משרי אפופטוזיס דוגמת קרני-X או גורמים אחרים המסבים נזק לדנ"א של התא, כמו תרופות כימותרפיות. ידוע כיום שנזק לדנ"א מדרבן תהליך אפופטוטי; הסיבה היא שבעקבות הנזק, התא יכול לייצר חלבון ששמו P53. כאשר תא-T בוגר מזהה פולש זר ונקשר אליו, מופעל החלבון P53 ומתחיל ייצור של חלבונים הגורמים לתהליך דלקתי שבו מושמד הגורם המזהם. עם חיסול גורם הזיהום, תא-T חייב להיכחד כדי למנוע תהליך דלקתי כרוני. לפיכך, עם סיום תפקידו מתאבד תא ה-T. גם פעילות ההרג של פולשים זרים לגוף מתבצעת באמצעות התהליך האפופטוטי המופעל ע"י תאי ההרג מסוג T.
התאבדות תאים ומחלות אוטואימוניות
תהליך אוטואימוני מתרחש בגוף כאשר תאי החיסון תוקפים בגוף תאים בריאים ומחסלים אותם. בשגרה יודעים תאי-T להבדיל בין פולש זר לבין מרכיבי הגוף העצמיים, וכבר נוכחנו כי בשלבי ההתפתחות העוברית מסולקים בבלוטת התימוס - בדרך של התאבדות תאים - אותם תאי-T שפועלים נגד מרכיבים עצמיים. בתהליך התאבדות מבוקר גם תאי-T שסיימו את פעילותם החיסונית מורחקים מהגוף. פגיעה בתהליך סינון זה, או החלשת תהליך המוות המתוכנן של תאים בשל ליקוי בחיסול התאים האוטואימוניים או כתוצאה ממוטציה, מאפשר היווצרות תאי-T שלהם הכרה של מרכיבי הגוף. כאשר תאים אלו עוברים עירור, בנסיבות שטרם פוענחו, מתוגברת פעילותם ופורצות מחלות אוטואימוניות. לפחות שתי מחלות אוטואימוניות כרוניות ידועות היום, שבהן מעורב תהליך אפופטוטי: מחלת הזאבת (לופוס) ודלקת פרקים ראומטואידית. היום חושבים שהתקדמות בהבנת התהליכים האחראים לחייהם ולמותם של תאי-T תיתן בידינו גישות חדשניות להפעלת תהליכי מוות בלימפוציטים אוטואימוניים הגורמים להרס רקמות בגוף.
מתברר כי רקמות מסוימות בגוף מצוידות במנגנון המסייע להן להתגונן מפני הרס עצמי, ביניהן רקמות באשכים, בעיניים, וייתכן שאף שבמוח. רקמות אלו מצוידות, ככל הנראה, בחלבון הקושר ומפעיל קולטני התאבדות בתאי-T; חלבון זה מקדם במהירות תהליך אפופטוטי בכל תא-T פעיל הנושא קולטני התאבדות המכונים "קולטני פאס" (Fas). פיתוח מעניין הנגזר מממצא זה הוא שימוש בתאים נושאי חלבון זה בתהליכי השתלה. אם אין התאמת רקמות מלאה בין תורם השתל למקבלו, רבים הסיכויים לדחיית השתל, ויש להיעזר בתרופות המדכאות את מערכת החיסון. ייתכן ששתלים בעלי תכולה גבוהה של חלבונים הקושרים קולטני התאבדות יהיו עמידים יותר במתקפה חיסונית, ולפיכך מתאימים יותר להשתלה.
על נגיפים והתאבדות תאים
התאבדות מתוכננת של תאים הכרחית לקיומנו. הפרעה במנגנון הבקרה שלה עשויה לגרום או לעודד מחלות, ובכללן מחלות נגיפיות. מרבית הנגיפים, לאחר חדירתם לתא מנסים לשתק את יכולתו לייצר את חלבוניו ומאלצים אותו לייצר את חלבוני הנגיף בלבד. עם זאת, עצם קיומו של התא חיוני לנגיף - בלעדיו אין לו קיום. הנגיף, אם כך, חייב להבטיח כי התא המאכסן יישאר בחיים וישרת את צרכיו. אחת הדרכים להבטיח זאת היא למנוע את תהליך האפופטוזיס בתא הנגוע. ואכן, נגיפים מסוימים פיתחו לשם כך מגוון אסטרטגיות. לדוגמה, נגיף אפשטיין-בר (Epstein-Barr, EBV) שגורם למחלת המונונוקלאוזיס המכונה גם "מחלת הנשיקות", ומעורב בכמה מחלות סרטניות של בלוטות הלימפה בבני-אדם, מייצר חלבונים מעכבי אפופטוזיס. נגיפים אחרים, כגון נגיף הפפילומה הגורם לסרטן צוואר הרחם, מעכבים או מפרקים את החלבון P53 המעורר את תהליך ההתאבדות. צופים כי בעתיד, יהיה אפשר להילחם בנגיפים בדרכים שימנעו את הנגיף מלייצר את החומרים הפוגעים בתהליך האפופטוזיס, כך שהתאים שנדבקו בנגיף יצליחו להמית את עצמם וימנעו התרבות של הנגיפים בגוף. למרבית המזל, מערכת החיסון מצוידת במנגנון ייחודי נגד פעילותו המתוחכמת של הנגיף. תאי-T מסוימים, הקרויים "תאי הרג", מסוגלים לזהות באמצעות הקולטנים שלהם מקטעים של חלבוני הנגיף בתאים המודבקים. תאי ההרג מתבייתים על התא הנגוע, ומחסלים אותו באמצעות מנגנוני הרג ייחודיים - גורמים לתהליך אפופטוטי בתאים הנגועים באמצעות הפעלת קולטנים המעוררים את תהליך ההתאבדות או באמצעות הזרקה של חלבונים מיוחדים, המכונים גראנזימים, לתאים הנגועים. הגראנזימים מפעילים את "אנזימי הסכין" - הקספאזות - המוציאים לפועל את תהליך ההרג של התא המודבק (ראו איור 1). לעתים תאי ההרג ממיתים בשגגה גם תאים בריאים הנמצאים בסמיכות לתאים המודבקים בנגיף. נזק נלווה זה מקורו ככל הנראה בהפעלה של קולטנים שנמצאים גם על פני התאים הבריאים ומשופעלים על ידי תאי ההרג בדומה לתאים המודבקים בנגיף. מניחים כי תהליך זה מסביר מדוע נגיף ההפטיטיס (דלקת כבד נגיפית) יכול לגרום לנזק רב בכבד גם אם תקף רק מעטים מתאיו.
תאים מתים על נקלה
מחלת האיידס היא אחת הדוגמאות הדרמתיות למוות נרחב של תאים הנגרם על ידי נגיף. נגיף הכשל החיסוני הנרכש, HIV, גורם לכשל של מערכת החיסון. תחילה נהרסת קבוצה אחת של תאי-T, המכונים "תאי-T מסייעים" או תאי CD4+, על שם הקולטן החלבוני שלהם הקושר אליו את הנגיף. תפקיד התאים המסייעים הוא לייצר גורמי גדילה שמעוררים את פעילותן של קבוצות תאים נוספות במערכת החיסון - התאים יוצרי הנוגדנים ותאי ההרג. חיסול תאי-T המסייעים גורר, אם כך, ירידה ניכרת במספר תאי ההרג והתאים יוצרי הנוגדנים. כאשר תאי-T מתמעטים, קטנה יכולת הגוף להילחם במחלות הפוקדות אותו ובמיוחד מחלות זיהומיות הנגרמות מנגיפים ומטפילים.
למרבה הפלא, רוב תאי-T המסייעים אצל חולי איידס מתים, לרבות אלה שלא הודבקו בנגיף. אין זה ברור מדוע תהליך כזה מתרחש. בדרך כלל כשנגיף פולש לגוף, תאי-T המסייעים מתרבים ומאפשרים לתאי ההרג להכניע את הנגיף, ורק לאחר ביצוע משימתם הם מתים. ייתכן שההתאבדות המופרזת של תאי-T המסייעים אצל חולי איידס נובעת מהתקשרות בין קולטן CD4+ של התאים הבריאים לבין חלבון נגיפי שמשתחרר מתאים המודבקים בנגיף. נוגדנים שמתפתחים בגוף נגד הנגיף יכולים להתקשר לשתי מולקולות סמוכות של CD4+ המחוברות לחלבון הנגיפי, ונוצר תלכיד המסמן לתא הבריא להרוס את עצמו. ייתכן שהאיתות להרס עצמי מקורו ביצירה מוגברת בטרם עת של קולטני התאבדות פעילים על פני תא-T מסייע בריא. תא-T מסייע לא נגוע, הנושא קולטני התאבדות פעילים, מועד למות מרגע שהוא מזהה את החלבון הנגיפי שבתא הנגוע. מפגש כזה מעורר את התהליך האפופטוטי. השערות אלה לא הוכחו עדיין. חוקרים סבורים שגם רדיקלים חופשיים של חמצן יכולים לעורר התאבדות של תאי-T מסייעים שאינם מודבקים בנגיף. רדיקלים חופשיים נוצרים בתאים המצויים בקשרי הלימפה של חולי האיידס, והם יכולים להרוס את הדנ"א ואת קרומי התא. ואמנם, חוקרים הצליחו למנוע תהליך התאבדות בתרביות תאים של חולי איידס בנוכחות מולקולות המנטרלות את פעילותם של רדיקלים חופשיים. ייתכן שיהיה אפשר לרפא את מחלת האיידס באמצעות טיפול שימנע את תהליך האפופטוזיס.
תאי סרטן מסרבים להתאבד
התא הסרטני השיג את מה שהאדם שאף להשיג במשך קיומו ולא עלה בידו: היכולת להיות בן-אלמוות. לתאים הסרטניים שמור הסוד לקיום חיי נצח - חייהם מסתיימים בדרך כלל רק לאחר כניעתו של הגוף הנגוע. בתנאי מעבדה, עם העברת התא הסרטני מהגוף למצע גדילה, הוא ממשיך לשגשג לנצח. בה בשעה שתאי הגוף הבריאים עושים עבודתם נאמנה ומוכנים למות ולפנות את מקומם בתום בצוע תפקידם כדי לאפשר לגוף המשך חיים תקין, תאי הסרטן "דואגים" לעצמם בלבד. הם שולחים גרורות לכל עבר, יוצרים תוהו ובוהו בגוף, וגורמים לבסוף לחיסולו. שגשוג בלתי מבוקר ומוגבר מחד גיסא, ואבדן היכולת למות מוות מתוכנן ומבוקר מאידך גיסא, הם המאפיינים העיקריים של מחלת הסרטן. סרטן מתפתח כתוצאה ממוטציות המתרחשות בכמה גנים בתא, האחראים לבקרת גידולו וקיומו. במצב תקין, כשמתרחשת בתא מוטציה שאיננה ניתנת לתיקון, התא מעדיף להרוג את עצמו מאשר להיות איום קיומי לגוף. אך אם התאים או צאצאיהם אינם מתים, הם צוברים במשך חייהם אינספור מוטציות שגורמות לתא להמשיך ולהתחלק באופן לא מבוקר, להתרחק מאזור הגידול ההתחלתי, וליצור גרורות של הגידול באזורים מרוחקים. בגידולים רבים נמצא שנזק גנטי הוא המונע את תהליך ההתאבדות. בתאים סרטניים רבים נפגע הגן המקודד את יצירתו של החלבון P53, האחראי לקידום תהליך אפופטוטי שנגרם עקב נזק לדנ"א. נמצא כי ביותר ממחצית הגידולים המוצקים - כגון בגידולים בריאה, במעי ובשד - חלה בגן P53 מוטציה המשבשת את פעילותו (ראו איור 2).
גם חלבונים נוספים המשתתפים בביצוע תהליך אפופטוטי מעורבים בתהליכים ממאירים. למשל, בלימפומות (סוגי סרטן הדם) מסוימות התאבדותם של התאים הסרטניים נמנעת בשל יצירה מוגברת של חלבון הידוע כמעכב תהליך של התאבדות התאים (המכונה Bcl2). בתאים סרטניים אחרים, כגון תאי מלנומה ממאירה (סוג של סרטן עור אלים), משערים שנפגעים קולטני התאבדות או שהתאים מייצרים חלבונים הנקשרים לקולטני ההתאבדות (חלבונים אלה קרויים "חלבונים קושרי פאס" - FasL) ומונעים ממערכת החיסון לקדם התהליך האפופטוטי.
ההתקדמות בהבנת תהליכים אפופטוטיים בכלל, ובתאי סרטן בפרט, מסייעת להבין מדוע גידולים רבים עמידים במידה רבה בפני קרינה וכימותרפיה. בעבר חשבו כי קרינה וכימותרפיה מכחידים גידולים בדרך ישירה בשל נמק המושרה בהם. כיום ידוע כי תאים מתים בדרך כלל כתוצאה מתהליך התאבדות. לפיכך, תאים שחסרים רכיבים של התהליך האפופטוטי, או המייצרים חלבונים המעכבים אותו, אינם מושפעים מפעולות הטיפולים האנטי סרטניים. היום נבדקת האפשרות להשתמש בריפוי גני כשיטה להתגבר על העמידות לתהליך האפופטוטי. בגישה נוספת מנסים למנוע מתאי הסרטן אספקה של גורמי גדילה החיוניים לשגשוגם, ועל ידי כך להשרות אפופטוזיס.
איור 2: P53 שומר התא
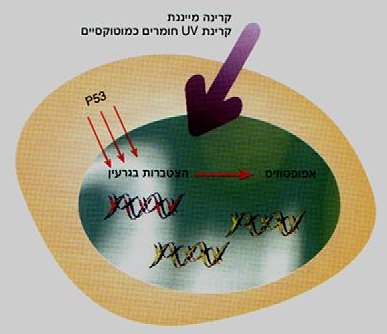
ריכוז P53 בגרעין התא נמוך, ונשמר קבוע ע"י קצבי יצור ופירוק מתואמים. בתא במצב תקין, מונע P53 חלוקה בלתי מבוקרת של התא, מוטציה ב-P53 גורמת לעלייה בריכוזו שמביאה לחלוקה לא סדירה של התא ולהתפתחות גידולים סרטניים

בתא הנפגע ע"' גורמים חיצוניים המשרים מוטציות בדנ"א ומסכנות את קיומו של התא, עולה ריכוזו של P53 המצטבר בתוך הגרעין; בעקבות כך מופעל התהליך האפופטוטי המסלק את התא הפגום
התאבדות בלב ובמוח
התאבדות תאים מתרחשת גם במקרים של אוטם שריר הלב ובשבץ מוחי. אירועים אלו נגרמים בעקבות חסימה של כלי דם המזין את שריר הלב או אזור מסוים במוח, כך שחלה הפסקה בזרימה תקינה של דם לאזורים אלו. בשני המקרים, תאים המצויים במרכז האוטם מתים באופן מידי מנמק בשל מחסור בחמצן ובגלוקוז והצטברות רמות רעילות של יוני סידן בתאים. בדיקה מדוקדקת מלמדת שגם תאים מרוחקים יותר מתים. הנזק בתאים מרוחקים אלו מתרחש לאחר מכן, ככל הנראה הן מנמק והן מהתאבדות. הדעה הרווחת כיום היא שהנזק המושהה נגרם בעטיים של רדיקלים חופשיים שנוצרים בתהלין הנמקי שהתרחש בתחילה, ולאחר מכן בעקבות חידוש אספקת הדם לאזור שבו הייתה החסימה. הגוף אינו מסוגל לייצר תאים חדשים במקום אלו שניזוקו בלב או במוח. עדיין לא ידוע בבירור אם חומרים הידועים כמעכבי תהליך אפופטוזיס יכולים למנוע את הנזק המשני הנגרם לתאי המוח והלב לאחר חידוש אספקת הדם. ייתכן שחומרים המעכבים יצירת רדיקלים חופשיים יכולים לסייע בהקטנת הנזק.
אפופטוזיס במחלות עצבים ניווניות
במחלות ניווניות של מערכת העצבים המרכזית - אלצהיימר, פרקינסון, הנטינגטון ועוד - מתרחש מוות הדרגתי של תאי עצב בכמה אזורים במוח. הרס תאי העצב גורם לנזקים קשים ביכולת החשיבה והזיכרון ולהפרעות מוטוריות קשות. מאחר שמותם של תאי העצב במחלות אלו אינו מלווה בתהליך דלקתי, משערים כי הרס התאים מתבצע בתהליך אפופטוטי. הגורם המעורר את ההתאבדות בתאי העצב במוח עדיין לא זוהה, וחרף כל הממצאים שנצברו עד כה, השאלה אם זהו אכן תהליך אפופטוטי עדיין נותרה פתוחה. חוקרים מצביעים על כמה גורמים "אשמים" בנזק שמתרחש בתאי העצב, ביניהם רדיקלים חופשיים, חוסר בגורמי גדילה ורמות גבוהות מדי של שליחים עצביים (נוירוטרנסמיטרים). תמיכה מסוימת בהנחה כי חומרים אלו מעוררים התאבדות תאים נתקבלה מניסוי שבו הזריקו את הנוירוטרנסמיטר גלוטמט (הידוע כשליח עצבי המשרה עירור בתאי עצב רבים) למוחן של חולדות בוגרות, ומצאו כי הוא גורם לפירוק הדנ"א בתאים. פירוק דנ"א הוא אחד המאפיינים של התהליך האפופטוטי.
בשנים האחרונות הדגימו חוקרים את קיומו של נזק אפופטוטי גם בתרביות של תאי עצב. חשיפה של תאי עצב מקליפת המוח בתרבית לנוירוטרנסמיטר גלוטמט גרמה תחילה לפירוק הדנ"א, וכעבור 24 שעות להרס נרחב של התאים. בנוסף על כך נמצא כי פעילותו הרעילה של הפפטיד ביתא עמילואיד (הידוע כמרכיב העיקרי המצטבר כלוחיות סביב תאי העצב המנוונים במוחם של חולי אלצהיימר) על תאי גידול אנושיים מסוג נוירובלסטומה, אף היא מלווה בפירוק הדנ"א ובשינויים המאפיינים את תהליך התאבדות התאים.
התאבדות בראי האבולוציה
על מרכזיותו של התהליך האפופטוטי בהתפתחותם ותפקודם התקין של יצורים חיים אפשר ללמוד מן העובדה שבמהלך האבולוציה נשמר תהליך זה הן בצורות חיים פרימיטיביות כגון היווצרות נבגים בפטריות עובש, והן ביונקים. גם העובדה שהתפתחו כמה מנגנונים ומסלולים בלתי תלויים המובילים את הפעולה הבסיסית של האפופטוזיס ומבצעים אותה, מצביעה על חשיבותו וחיוניותו של תהליך ההתאבדות המכוונת מראש של התא החי. לכאורה, תהליך התאבדות התאים, הטבוע בכל תא מגופנו, יכול להיחשב כברירת מחדל, דהיינו: להתאבד באופן אלגנטי ובלתי מזיק לסביבה כתגובה לשיבוש בפעולות התא. בפועל, התהליך האפופטוטי ממלא תפקיד חשוב ביותר בתהליכים הבסיסיים והמרכזיים במהלך חייו של היצור החי, כמו התפתחות עוברית, היווצרות איברים, התמיינות ועיצוב הרפרטואר של מערכת החיסון. בתהליך עיצוב הגוף והתמחות האיברים והמערכות השונות, משתתפים עודפי תאים הנודדים לעתים מרקמות עובריות, והאינטראקציות ביניהם מביאות להתפתחות הרקמה או האיבר הייחודי. רק לאחר שנוצר המבנה ממשיכים התאים שקיבלו את האיתות הנכון להתפתח, ולעומת זאת, ביתר התאים מופעל מנגנון ההתאבדות והם מתחסלים ומוצאים מן המערכת.
במערכת החיסון, שבה נוצרים באופן שוטף לאורך חיינו תאים חדשים (לימפוציטים מטיפוס T או B) מתאי אב במח העצם, אחראי התהליך האפופטוטי לעיצובם של השונות הגדולה והמגוון הרב המאפיינים את יכולתם של לימפוציטים אלו להגיב כנגד מגוון עצום של פולשים זרים.
ברור, אם כן, שתהליך התאבדות התאים הוא צורך חיוני לגופנו. תהליך האפופטוזיס טבוע בתא, ומופעל בהתאם לתכנית ולמנגנון מתוכנתים מראש, או כברירת מחדל לסילוק מהיר ויעיל של תאים פגומים וחריגים. המחיר שמשלם היצור החי על ה"בזבוז" בעודף התאים הבלתי מנוצל בשלבי ההתפתחות העוברית, והאנרגיה שהוא משקיע בחיסולם של תאים אלו מוחזרים בריבית דריבית, שהרי מנגנון חיסול התאים שומר על פעילותו התקינה של הגוף. לפיכך, כל פגיעה בתהליך זה עלולה לגרום, או לעודד, מחלות רבות וקשות.
לקריאה נוספת
Richard C. Duke, David M. Ojcius, and John Ding-E Young: Cell Suicide in Health and Disease. Scientific American December 1996, pp: 48-55
.
.