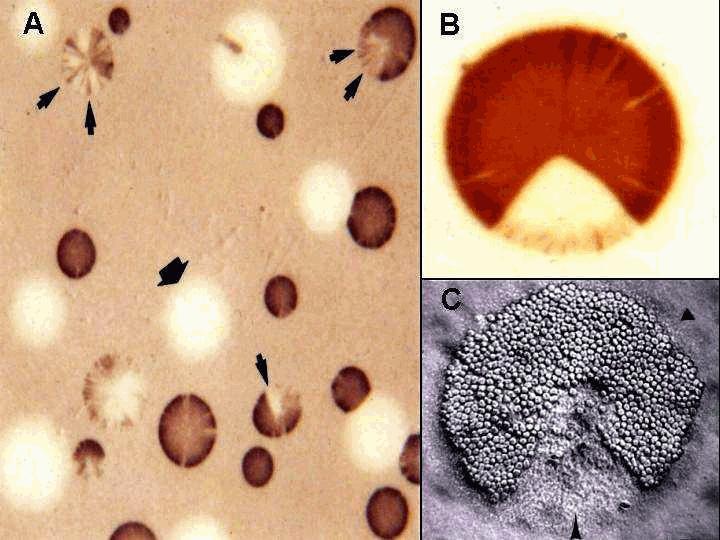
המושג וריאביליות אנטיגנית או כפי שמכונה גם בשם Phenotypic Switching, מתייחס ליכולתו של החיידק לשנות במהירות את הרפרטואר האנטיגני של רכיבי פני שטח התא המהווים מטרות מרכזיות לתגובת נוגדני המאכסן. תצפית באוכלוסיית חיידקים מגלה תופעה זו. אוכלוסייה גדלה ומתרבה של חיידקים, הגם שמקורה מזן אחד או אפילו ממושבה בודדת, יוצרת באופן ספונטני ואקראי פרקציה של תאים המכונים variants, השונים אנטיגנית מהפנוטיפ הדומיננטי של כלל האוכלוסייה. תדירות הופעתם של וריאנטים אלו בכלל האוכלוסייה מדהימה ובמקרים רבים נעה בין 10-2-10-3/cell/generation. איתור הוריאביליות האנטיגנית נעשה בשיטה שפיתחנו המכונה colony immunoblot ובה מועברות מושבות החיידקים לממברנת ניטרוצלולוז ומוגבות עם נוגדנים חד-שבטיים המכירים חלבוני שטח פנים של החיידק הנבדק. מושבות המבטאות את החלבון הנבדק מזוהות בנקל ע"י ראקצית צבע עם הנוגדן בעוד שמושבות בהן החלבון הנבדק אינו מבוטא אינן נצבעות (ראה תמונה, פנל A). אוכלוסייה של חיידק פתוגני איננה אם כן הומוגנית מבחינה אנטיגנית ומכילה באופן תדיר רפרטואר רחב ומשתנה של פנוטיפים השונים בתצוגה האנטיגנית שלהם. אוסף זה של וריאנטים מכיל פוטנציאלית את אותו וריאנט המסוגל לשרוד שינוי פתאומי בתנאי הסביבה החיצונית או לשרוד את תגובת המערכת החיסונית של המאכסן. וריאנטים אלו מכונים בספרות בשם escape variants.
כיצד נוצרים וריאנטים אלה בתוך אוכלוסית הפתוגן? חקר הבסיס המולקולרי גנטי של תופעת הוריאביליות האנטיגנית שנעשה בשנים האחרונות הראה כי חומר גנטי רב מוקדש ע"י הפתוגן לצורך מטרה זו וכי מנגנונים גנטיים מסוג Random genetic control הם המאפשרים את השינויים המהירים בביטוי חלבוני שטח הפנים. אולי הדוגמא המאלפת ביותר למספר הגנים הרב המעורב בתהליך זה הינן המיקופלסמות המהוות את המיקרואורגניזמים הקטנים ביותר בטבע המקיימים כושר התרבות עצמאי. הגנום המיקופלסמתי זעיר וגודלו נע בין 600-1500 Kb בלבד. למרות זאת מספר הגנים האחראים ליצירת וריאביליות אנטיגנית רב ביותר ומהווה בין 10%-2% מכלל הגנום.
הגנים האחראיים ליצירת הוריאביליות הפנוטיפית מאורגנים בד"כ יחד כצבר כרומוזומלי, אולם כל גן מהווה יחידת שעתוק עצמאית. כל גן מכיל אתר מיוחד המאפשר את התרחשותם של שינויים מהירים ברמת ה-DNA כגון: מוטציות מקומיות או תהליכי רה-אירגון רחבים יותר. אתרים יחודיים אלה המכונים Hot Spot ממוקמים בגן הסטרוקטורלי עצמו או באיזור הבקרה שלו ומאופיינים בסידור נוקלאוטידים מיוחד כגון רצפים חוזרים (tandem repeats), שרשרות הומופולימריות (homopolymeric tract) או רצפים המאפשרים תהליכי רקומבינציה מהירים ביותר. אזורים אלו, המכונים גם בשם highly mutable modules, אינם יציבים ונתונים לשינויים עקב שגיאות תכופות החלות בזמן שיכפול ה-DNA או עקב תהליכי רקומבינציה בין אזורים הומולוגים המצויים בגנים השונים שבצבר. כתוצאה משינויים אלו, ארועים כגון חסר או הוספה של יחידות חוזרות, שינוי במספר נוקלאוטידים המרכיבים את השרשרות ההומופולימריות וטרנסלוקציה של פרומוטורים הינם ארועים שכיחים ביותר ומשמשים כמתג הפעלה וכיבוי יעיל ומהיר של הגנים (ON/OFF Switching). פיתוח מנגנונים המאפשרים כיבוי והדלקה של גנים המעורבים באינטראקצית הפתוגן עם המאכסן ע"י העלאת תדירות המוטציות בגנים אלו, מקנה לפתוגן אמצעי יעיל ומהיר להתמודד עם לחצי הסביבה המופעלים ע"י המאכסן.
שינויים אלו ברמת ה-DNA אינם מתוכנתים, אינם תלויים בד"כ בסביבה החיצונית וחלים באופן ספונטני רק בחלק מהתאים מכלל אוכלוסית הפתוגן. אלו אותם וריאנטים בעלי התצוגה האנטיגנית השונה. השינויים המהירים ברמת ה-DNA הינם הפיכים ומאפשרים לכל גן לעבור ממצב פעיל למצב שקט ולהיפך באותה תדירות. דבר זה בא לידי ביטוי בתצפית ברמת המושבה הבודדת. שימוש בנוגדן חד-שבטי המכיר חלבון וריאבילי מסויים מאתר תגובה סקטוריאלית של המושבה בה ניתן לזהות בברור איזור הנצבע ע"י הנוגדן המבטא את החלבון וסקטור אשר אינו מבטא את החלבון (ראה תמונה, פנל B).
לאחרונה התברר כי חלק מהחלבונים הוריאביליים בחיידקי המיקופלסמות מעורב בתהליך ההיצמדות של החיידק לתאי התא המאכסן. אחד המבחנים המקובלים לבחינת יכולת ההיצמדות של המיקופלסמות הינו הצמדות לתאי דם אדומים (hemadsorption). במהלך חקר תהליכי ההצמדות של המיקופלסמה נתגלה כי מספר חלבוני שטח פנים הנתונים לוריאביליות אנטיגנית בתדירות גבוהה משמשים כחלבוני קישור (adhesins) של המיקופלסמה. תצפית מאלפת המראה את הקשר בין חלבוני שטח פנים וריאביליים לבין יכולת ההצמדות של המיקופלסמה הינה יצירת סקטורים ברמת המושבה הבודדת ע"י אריטרוציטים בדיוק באותו האופן בו נוצרו סקטורים ע"י קישור הנוגדן לחלבון שטח הפנים (ראה תמונה, פנל C). הצמדותם הסקטוריאלית של אריתרוציטים למושבות המיקופלסמה מהוות את העדות הראשונית למעורבותם של חלבונים וריאביליים בתהליך ההצמדות של מיקופלסמות פתוגניות.