אך בעוד שהשד הגרעיני עדיין כלוא והוא בגדר איום בלבד, הרי שמבקבוקי האנטיביוטיקה כבר חמק לו הג'ין - עמידותם של החיידקים בפני אנטיביוטיקה. אכן, כיום, יותר מחמישים שנה מאז טופלו לראשונה חולים ופצועים בפניצילין, וכשעל גבי המדף מונחות מוכנות לשימוש יותר ממאה תרופות אנטיביוטיות שונות, אנשים מתים ממחלות שלכאורה היו אמורות להפוך לנחלת ההיסטוריה. ואין מדובר באזורים נחשלים: על פי דיווח המרכז האמריקני לבקרת מחלות ולמניעתן, בשנת 1992 מתו בארצות הברית יותר מ-13 אלף מאושפזים בבתי חולים בגלל זיהומי חיידקים העמידים בפני תרופות אנטיביוטיות. ואם אין די במספר מבהיל זה, העתיד נראה מבהיל אף יותר. במארס השנה פורסם בניוזוויק מאמר, שכותרתו "קץ האנטיביוטיקה" נכתבה באותיות גדולות ומודגשות. באפריל יוחד רובו של אחד מגיליונות העיתון המדעי היוקרתי סאיינס (Science) לנושא, אך כותרתו הייתה מאופקת יותר: "עמידות בפני אנטיביוטיקה". קודם הרשינו לעצמנו להדביק לתופעת עמידותם של החיידקים בפני האנטיביוטיקה את הכינוי ג'ין (Jinn), הן כדי לתארה כשד מסוכן שבקע מתוך בקבוקי התרופות, והן כחידוד לשוני, המרמז כי מקור שד זה בשינוי תורשתי, שינוי של גן (Gene).
אין לטעות ולחשוב כי חיידקי בתי החולים עמידים, חלילה, בפני כל התרופות האנטיביוטיות - לא, עדיין לא הגענו לקץ האנטיביוטיקה - אולם כיום זנים רבים עמידים בפני רבות מהתרופות, ולעתים עד שהצוות הרפואי מצליח לזהות תרופה יעילה נגד החיידק, מערכות החולה עלולות להיפגע פגיעה קטלנית, וצפוי שהמצב יחמיר. כיום, רבים מן הזנים של החיידק סטפילוקוקוס אאוראוס (Staphylococcus aureus), השורצים בבתי החולים, עמידים בפני כל סוגי האנטיביוטיקה, למעט אחד - ואנקומיצין. ברור לכול כי בשלב כלשהו ירכוש אחד הסטפילוקוקים עמידות גם בפני ואנקומיצין; לכשייפרץ קו הגנה אחרון זה, יהיו הרופאים והחולים חסרי אונים, כמו בימים של טרם אנטיביוטיקה.
תרופות יוצאות דופן
בשנת 1929 דיווח אלכסנדר פלמינג (Fleming) על תצפית שערך: מושבות של סטפילוקוקים נעלמו מקרקע הגידול, או ליתר דיוק עברו תמס (lysis), כשהתפתחה בקרבתן פטריית העובש פניציליום (Penicillium). עברו 11 שנים עד שהצליחו צ'יין, פלורי (Chain , Florey) ועמיתיהם למצות כמות ניכרת של פניצילין מפטריית העובש פניציליום נוטטום
(P. notatum). ב-1941 החלו להשתמש בפניצילין לצורכי רפואה, וכבר במלחמת העולם השנייה ניצלו חייהם של פצועים רבים הודות לזריקות הפניצילין. ב-1949 כבר ייצרו מפעלי התרופות כמויות שענו על דרישות השוק. התברר כי פניצילין G הוא תרופה יעילה מאוד נגד מינים רבים של חיידקים פתוגניים, והשימוש בו אינו כרוך בדרך כלל בתופעות לוואי שליליות. ואולם לפניצילינים המקוריים, שכולם הופקו מפטריות עובש, היו ארבעה חסרונות: פעילותם כנגד חיידקים גראם שליליים (ראו תיבה) הייתה נמוכה; הם גילו רגישות לחומצות, ולפיכך לא היה אפשר לקחתם בבליעה מפני שהם נהרסו בקיבה; הם עוררו תגובות אלרגיות של אנשים מסוימים (הבעיה מוכרת גם כיום); הם פורקו על ידי האנזים פניצילינז. כדי להתגבר לפחות על מקצת חסרונות אלה, ניסו צ'יין ועמיתיו להפיק את המולקולה המשותפת לפניצילינים השונים ולפתח תרופה טובה יותר. מאמציהם אכן נשאו פרי ב-1957 וכך נפתחה הדרך ליצירת פניצילינים מלאכותיים למחצה (סמי-סינתטיים), ובהם פניצילינים (כמו אמפיצילין, אמוקסיצילין), שאפשר לקחתם בבליעה, בהיותם עמידים בפני חומציות הקיבה. הפניצילינים שייכים לקבוצת תרופות הפוגעות בדופן תא החיידק. מולקולות הפניצילין נקשרות לחלבונים מיוחדים (המכונים "חלבונים קושרי פניצילין") בדופן. חלבונים אלו ממלאים תפקידים שונים בשלבי בניית הדופן, והתקשרותם למולקולות הפניצילין מונעת את השלמת הבנייה. תא החיידק, שהמגן המכני שלו ניזוק, מתפוצץ בגלל ספיגה אוסמוטית של מים. אחד ממנגנוני ההגנה היעילים של החיידקים נגד הפניצילין הוא יצירת הפניצילינז - אנזים מפרק פניצילינים. כבר בשנת 1940, עוד לפני תחילת השימוש הרפואי בפניצילין, זיהו אברהם (Abraham) וצ'יין אנזים המופרש על ידי חיידקים והמפרק פניצילין. אמנם הם שיערו כי האנזים עלול לחבל ביעילות השימוש התרופתי בפניצילין, אך יש להניח כי אפילו הם לא ידעו עד כמה צדקו. גם ואנקומיצין שהזכרנו לעיל, הורג חידקים בדרך של פגיעה בדופן תא החידק, אף שאינו נמנה עם קבוצת הפניצילינים.
תרופות אנטיביוטיות רבות אינן פוגעות בדופן תא החיידק אלא באתרים ובתפקודים אחרים. יש תרופות הפוגעות בתפקודי קרומית תא החיידק, ויש תרופות הפוגעות בתהליכי בניית חומצות הגרעין; תרופות אנטיביוטיות רבות פוגעות בתהליך בניית החלבונים.
|
הדופן הסוגרת על החיידק
כמו בכל תא, גם הציטופלסמה של תא החיידק עטופה בקרומית תא (ממברנה) דקיקה, המצטיינת בחדירות בררנית. אך בניגוד לתאיהם של בעלי החיים, מוגנת קרומית תא החיידק בדופן העוטפת אותה מבחוץ. לדופן התא חוזק מכני ניכר, המונע את קריעתה של הקרומית והתפוצצות תא החיידק עקב חדירה אוסמוטית של עודף מים. דופן מגינה מוכרת גם מתאי הצמחים, אלא שההרכב הכימי של דופן תא הצמח שונה לחלוטין מהרכבו הכימי של דופן תא החיידק. פגיעה בשלמות הדופן גורמת בדרך כלל לחדירת מים ופיצוץ אוסמוטי של החיידק. דופן התא, הגם שהוא מצטיין בחוזק מכני ניכר, הוא נקבובי, כך שאינו מהווה מחסום בפני מעבר מולקולות קטנות, כגון תרופות. את החיידקים ממיינים לפי אופן צביעתם בשיטת צביעה המכונה "צביעת גראם". מקצת החיידקים נצבעים בסגול שאינו ניתן לשטיפה, והם מכונים לפיכך "גראם חיוביים", ומקצתם מאבדים את הצבע בשטיפה, והם מכונים "גראם שליליים". הבדלים אלו בצביעה מורים על הבדלים בתכונות. בחיידקים גראם שליליים עטופה הדופן מבחוץ בשכבה של מעין קרומית תא. קרומית חיצונית זו - בדומה לקרומית התא - היא בעלת חדירות בררנית, כך שחומרים רבים, ובהם תרופות, מתקשים להגיע לדופן החיידק הגראם שלילי, בעוד שדרכם לדופן התא בחיידק גראם חיובי (שהוא חסר קרומית חיצונית) פתוחה. בתוך הקרומית החיצונית, שהיא יחסית בלתי חדירה, ערוכים חלבונים מיוחדים, היוצרים כעין תעליות (נקבוביות ?) (pore=תעלה) המקלות את המעבר של חומרים מסיסים במים. הבדל נוסף בין החיידקים הגראם חיוביים לגראם שליליים הוא בעובי הדופן: עובי רב יחסית בגראם חיוביים, ומועט יחסית בגראם שליליים. |
לריב עם ריבוזום - לחבל בחלבון
להלן מספר תרופות אנטיביוטיות ואתרי השפעתן בתא החידק. כלורמפניקול (הידוע בשמו המסחרי סינטומיצין) הופק לראשונה ב-1947 ממין של חידק סטרפטומיצס (Streptomyces). כבר ב-1949 החלו לייצרו באופן סינתטי. כלורמפניקול נקשר לריבוזומים שבתא החיידק - אותם אברונים המשמשים כ"בתי החרושת לחלבונים", וכך מעכב את ייצור החלבונים בחיידק. בקרב אוכלוסיות החיידקים אפשר למצוא מוטנטים עמידים יחסית לכלורמפניקול בהיותם חדירים פחות לתרופה; מלבד זאת יש חיידקים המייצרים אנזים המבצע שינוי כימי במולקולת הכלורמפניקול, וכך מבטל את פעולתה כתרופה. אמינוגליקוזידים - קבוצת תרופות אנטיביוטיות (בהן: סטרפטומיצין, נאומיצין) הנקשרות לריבוזומים של תא החיידק ומעכבות ייצור חלבונים. במרוצת השנים התפתחו בחיידקים כמה מנגנוני עמידות בפני אמינוגליקוזידים, כגון מנגנונים המונעים מן התרופה לחדור לתא החיידק; התפתחו חלבוני ריבוזומים חסרי זיקה לתרופות; אנזים המבצע שינוי כימי בתרופה ומבטל בכך את פעילותה. סטרפטומיצין בודד לראשונה ממין של סטרפטומיצס בידי וקסמן ו-שץ (Waksman, Schatz) ב-1944. טטרציקלינים - קבוצת תרופות, שראשון נציגיה בודד בשנת 1948 ממין של סטרפטומיצס. לאחר שהם חודרים לתא החיידק, הטטרציקלינים נקשרים לריבוזומים ומעכבים את בנייתם של החלבונים. העמידות לטטרציקלינים עשויה להיווצר בגלל אי-חדירתם לדופן התא, או שלחיידק יש מנגנון הדחה אקטיבית (סילוק אל מחוץ לחיידק בעזרת משאבה הצורכת אנרגיה). מקרולידים - התרופה המוכרת ביותר מקבוצה זו היא אריתרומיצין. היא הופקה לראשונה בשנת 1952 מאחד ממיני הסטרפטומיצס. המקרולידים נקשרים לריבוזומים ומונעים את בנייתם של חלבונים בתא החיידק. עמידותם של חיידקים בפני מקרולידים היא תופעה נפוצה למדי, ומקורה בריבוזומים שמרכיביהם חסרי זיקה למקרולידים. |
עמידות - כיצד?
הגורמים שמקנים לחיידקים עמידות (מוחלטת או שרגישותם לתרופה נמוכה) בפני תרופה אנטיביוטית מסוימת רבים ושונים. במקרים רבים, חיידקים שקצב המטבוליזם והרבייה שלהם איטי עמידים יותר בפני סוגים מסוימים של אנטיביוטיקה. כזה הוא, למשל, חיידק השחפת. במקרה אחר, בחיידקים גראם שליליים, הקרומית החיצונית העוטפת את הדופן מקשה את המעבר של חומרים מסוימים ובהם תרופות. התופעה המעניינת והמאיימת במיוחד היא עמידותם של החיידקים שמלכתחילה היו רגישים לתרופה. התופעה הזאת היא דוגמה לתהליך אבולוציוני, ש"הדלק" המניע אותו הוא לחץ בררתי (סלקציה) חזק, הנוצר בתנאים של שימוש בתרופות אנטיביוטיות. מאחר שמדובר בשינויים מהירים ביותר - שהרי כל ההיסטוריה של השימוש הרפואי בתרופות אנטיביוטיות אינה עולה הרבה על 50 שנה - אפשר בהחלט לומר כי לפנינו אבולוציה-בעין, או: אבולוציה בזמן-אמת. יש לזכור כי מדובר בשינויים תורשתיים - האוכלוסייה העמידה שונה מבחינה גנטית מן האוכלוסייה המקורית, הרגישה לתרופה.
מנגנונים רבים עשויים להקנות עמידות לזני חיידקים שהיו רגישים במקורם. מנגנון אחד הוא הופעת גן המקודד יצירת אנזים הפועל על התרופה, אם בדרך של פירוק כימי, ואם בדרך של שינוי כימי אחר, ובכך מבטל את יעילותה. מנגנון אחר הוא שינוי במולקולת המטרה - המולקולה של החיידק שבה התרופה פוגעת. במקרה זה ניתן להבחין בין שינוי (מוטציה) בגן קיים, המקודד את יצירת המולקולה, לבין "רכישה" של גן המקודד יצירת אנזים חדש לחלוטין בתא, אנזים המנטרל את התרופה.
מנגנון מקנה עמידות נוסף הוא שינוי תכונות החדירות של הקרומית (של קרומית-התא, או של הקרומית החיצונית בחיידקים גראם שליליים), ההופך אותה לפחות חדירה לתרופה. שינוי כזה אינו יכול להקנות, בדרך כלל, עמידות מוחלטת (שהרי אם מדובר במולקולות קטנות, חדירות כלשהי תיוותר בכל מקרה), אלא רק בהקטנת רגישותו של החיידק לתרופה. אפשרות רביעית היא רכישת מנגנון להדחת התרופה מתוך התא בעזרת חלבון מיוחד הממוקם בקרומית ומשתמש באנרגיה לשם סילוק פעיל של התרופה מהציטופלסמה החוצה. מתחילת שנות השמונים מתבררת חשיבותה של הדחה אקטיבית כמנגנון מקנה עמידות. זאת בעקבות מחקריו של סטיוארט לוי (S. Levy) ועמיתיו מאוניברסיטת טאפטס בבוסטון. המחקרים הוכיחו כי עמידותם של זנים מסוימים של חיידקי קולי (E. coli) בפני טטרציקלינים נובעת מהדחת התרופה החוצה תוך שימוש באנרגיה. לאחרונה נצפו מקרים שבהם פועלים מנגנוני הדחה "כלליים", רחבי טווח, שאינם סגוליים לתרופה אחת או לקבוצה מצומצמת של תרופות, אלא מסלקים קשת תרופות רחבה ומגוונת. הצירוף של הקטנת חדירות והפעלת משאבה מדיחה הוא יעיל במיוחד - כך יכול החיידק להיות מוגן לחלוטין מפעולת האנטיביוטיקה.



כדאי להאיר פרט הנוגע להדחת תרופות מתאיהם של חיידקים גראם שליליים: המשאבות הפעילות ממוקמות בקרומית התא. לפיכך בחיידקים גראם שליליים המשאבות מסלקות את התרופה, לכאורה, אל האזור הכלוא בין קרומית התא לבין הקרומית החיצונית, אזור המכונה פריפלסמה. הדחה מעין זו לא הייתה מביאה תועלת רבה לחיידק. והנה, מתברר כי בחיידקים גראם שליליים יש חלבונים מיוחדים, המשמשים, על פי ההשערה, כחלבוני עזר. ההנחה היא כי חלבונים אלה חוצים את הפריפלסמה, ודרכם עוברים חומרים שסולקו על ידי המשאבה אל מחוץ לקרומית החיצונית.
הגן עובר חביבי
כיצד "הצליחו" החיידקים להתגבר על תרופות, שעמל רב, מחשבה והון עתק הושקעו בפיתוחן, והותירו את הרופאים במקרים רבים חסרי אונים? כיצד אוכלוסיות חיידקים רגישות רוכשות לעצמן עמידות בפני תרופות אנטיביוטיות? מדובר, כפי הנראה, במנגנונים יעילים ביותר, שהצליחו להפתיע אף את מרחיקי הראות שבין החוקרים. באחד המנגנונים מדובר רבות בהקשר לאבולוציה - מנגנון המוטציות: שינוי בהרכב הדנ"א הגורם לשינוי בחלבון המקודד על ידי אותו מקטע דנ"א שהשתנה. חלבון כזה יכול להיות אנזים, או חלק ממבנה חלבון ריבוזומי, למשל. אם אותו חלבון הוא מולקולת המטרה של התרופה האנטיביוטית, די בשינוי קטן בה כדי להופכה לבלתי רגישה לתרופה. כך, בעקבות מוטציות המביאות לשינוי במרכיבי הריבוזומים, יכולים להופיע חיידקים עמידים בפני סטרפטומיצין או אריתרומיצין. בעקבות מוטציות הגורמות לפגיעה בחלבוני דופן החיידק, יכולים להופיע זנים עמידים בפני הפניצילינים למיניהם. בעקבות מוטציה המתבטאת באנזים בונה רנ"א (רנ"א פולימרז), יכולים להופיע זנים העמידים בפני אנטיביוטיקות מקבוצת הריפמיצינים.
מוטציה יכולה גם להרחיב את טווח פעולתו של האנזים של החיידק ולאפשר לו לבטל את יעילותה של אנטיביוטיקה חדשה, שפותחה לאחר שקודמתה "נוצחה" בידי החיידקים, וכך להוריד לטמיון עמל, השקעות ותקוות. מאז שנתגלו הפניצילינים נוצר "מירוץ חימוש" בין חברות התרופות לבין החיידקים: אלו פיתחו כל העת תרכובות חדשות הפועלות נגד חיידקים עמידים, ואלה מצדם פיתחו כל פעם עמידות חדשה כלפי "תרופת הפלא" האחרונה. במקרים רבים די בשינוי של חומצה אמינית אחת לאורך השרשרת המרכיבה את האנזים, כדי לגרום לשינוי בתחום פעולתו. שינוי של חומצה אמינית אחת בחלבון נובע משינוי בשלשה אחת של נוקלאוטידים לאורך הגן בדנ"א של החיידק. במקרים רבים, שינוי של נוקלאוטיד יחיד משנה את משמעות השלשה כולה, שמתבטאת בחומצה האמינית שהיא מקודדת. שינוי של נוקלאוטיד בודד לאורך הדנ"א הוא מוטציה נקודתית. בהקשר זה מעניין סיפורם של האנזימים מפרקי הפניצילין המקנים לחיידקים עמידות נגד פניצילין: אפשר לעקוב אחר "שושלות יוחסין" גנטיות של אנזימים אלו, הנבדלים זה מזה בחומצה אמינית אחת בלבד לאורך השרשרת הארוכה, ובד בבד להתחקות אחר התרחבות קשת התרופות שהם מפרקים.
מוטציות נקודתיות יכולות גם "להסב" אנזימים המתפקדים במסגרת חילוף החומרים הרגיל של התא - למשל במטבוליזם הסוכרים - לכאלה הפועלים על תרופות אנטיביוטיות ומנטרלים אותן. אך כיצד אפשר להסביר את הופעתם המהירה של אנזימים המסוגלים לפעול על תרופות אנטיביוטיות חדשות, בחיידקים שהיו בתחילה רגישים להן? מתברר כי הופעת עמידות בפני אנטיביוטיקה בזנים פתוגניים נובעת פעמים רבות, לא מיצירת אנזים חדש באמת (תהליך אבולוציוני ממושך גם כשמדובר באוכלוסיות ענק ובחיי דור קצרצרים האופייניים לחיידקים), אלא מתהליך של רכישת עמידות גנטית העוברת מחיידק לחיידק.
כיצד קורה הדבר? בטבע באים החיידקים במגע עם חומרים אנטיביוטיים רבים ושונים; עצם המונח "אנטיביוטיים" מעיד על מקורם הטבעי של חומרים אלה - הפרשות של יצורים חיים. בקרב אוכלוסיות החיידקים שהיו חשופות לחומרים אנטיביוטיים טבעיים במשך מיליוני שנים אכן נוצרו אנזימים מקני עמידות. זה מכבר ידוע כי חיידקים נוטים להחליף קטעי דנ"א זה עם זה. היום אכן מתברר עד כמה תופעה זו שכיחה. בתהליך מיוחד הקרוי קוניוגציה, מתקשרים חיידקים זה לזה ומחליפים ביניהם פלסמידים (קטעי דנ"א עצמאיים הנפוצים בקרב החיידקים; הם כוללים גנים חשובים, ובהם גנים לעמידות). חיידקים מעבירים גם קטעי כרומוסומים. גם נגיפי החיידקים משמשים כנשאים המסוגלים להעביר גנים מחיידק לחיידק. בתהליך המכונה טרנסדוקציה.
מושבות של שני מיני סטפילוקוקים. הגדולות שבהן שייכות לסטפילוקוקוס אאוראוס |
 |
תרביות חיידקים שנלקחו ממשטח אף |
 |
ותצפית מפתיעה: במקרים מסוימים חשיפת חיידקים לחומר אנטיביוטי מגבירה את נטייתם להיצמד לבני זוג ולהחליף פלסמידים, שלעתים כוללים גנים המקנים עמידות כלפי אותה אנטיביוטיקה עצמה, ו/או לאנטיביוטיקות אחרות.
והשערה אולי מפתיעה אף יותר: כבר לפני יותר מעשרים שנה סברו החוקרים כי אחד המקורות הפוטנציאליים החשובים של גנים מקני עמידות הם חיידקים המייצרים בעצמם חומרים אנטיביוטיים. מתברר כי לרבים מייצרני החומרים האנטיביוטיים יש אנזימים, המנטרלים באופן כימי את תוצריהם - הדבר מונע מהחיידק המייצר "להתאבד" בתוצריו שלו. ואמנם כשהשוו בין החומר התורשתי של חיידקים מייצרי אנטיביוטיקה ובין זנים פתוגניים עמידים השורצים בבתי החולים, נמצאה התאמה, המעידה כי החיידקים הפתוגניים רכשו תכונות עמידות שמקורן בחיידקים המייצרים אנטיביוטיקה. אחת המסקנות שניתן לגזור מכך - מסקנה השייכת, בעצם, לפרק הבא: עדיף לנסות לייצר אנטיביוטיקה מלאכותית, שאין לה אח ורע בטבע, משום שבאין יצרנים טבעיים אין מקור להפצת עמידות.
מסקנה אחרת היא כי אם התגלתה עמידות בזן כלשהו של חיידקים, יש לצפות כי בתוך זמן מה היא תתפשט גם למיני חיידקים אחרים. ובעניין זה: מתברר כי כ-20 אחוזים מכלל האנטרוקוקים (חיידקי המעיים) השורצים בבתי החולים עמידים בפני ואנקומיצין. מכאן החשש הגדול - ובעצם, הוודאות המרה - כי בסופו של דבר תגיע עמידות זו גם לסטפילוקוקוס אאוראוס - אויב המאושפזים, שכזכור, זנים שלו עמידים כיום בפני כל סוגי האנטיביוטיקה למעט ואנקומיצין. וכשכך יקרה, הרפואה תהיה בצרה גדולה.
טינת המומחים, עטין הפרה ועתיד הרפואה
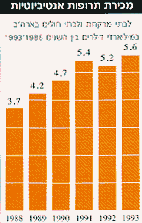
"אם אגזים במינון התרופה ליתר לחץ דם לחולה שלי, יש חשש רב שאזיק לו, אך בשום אופן לא אזיק בכך לחולים אחרים. לעומת זאת, אם אגזים במינון של אנטיביוטיקה, אני הופך אותה ליעילה פחות עבור כל החולים הזקוקים לה". כך אומר פרנק ראם (Rhame), מנהל היחידה לבקרת זיהומים בבית החולים של אוניברסיטת מינסוטה בארה"ב, ומצביע על פרדוקס ועל דילמה. אכן, השימוש בתרופות אנטיביוטיות הוא חרב פיפיות. אך טענותיהם וטינתם של המומחים אינן מכוונות רק כלפי רופאים הרושמים תרופות אנטיביוטיות ביד נדיבה מדי, אלא גם כלפי "זוללי האנטיביוטיקה" - בעצם רוב האוכלוסייה. רופא שקול, המנסה לשכנע את החולה שלו, כי כאב הגרון מקורו בזיהום נגיפי ואין שום טעם ושום צורך באנטיביוטיקה, מגלה פעמים רבות כי החולה יעדיף בעתיד רופא "נדיב" יותר על פניו ... אבל חטאי הרופאים והחולים בטלים בשישים (ולמען הדיוק - בשלושים) ביחס למשולש חקלאי-וטרינר-פרה. בעלי החיים במשק החי החקלאי מקבלים פי 30! יותר אנטיביוטיקה מאשר בני האדם. בארה"ב מתירים שלטונות הבריאות את קיומם של 80! סוגי אנטיביוטיקה שונים בחלב (אמנם, בריכוזים נמוכים). הם משמשים בעיקר למניעת דלקות בעטיני הפרות. פירוש הדבר הוא כי בעת שתיית כוס חלב חודרים לגופנו חומרים אנטיביוטיים. הוכח כי אפילו הריכוזים הנמוכים המותרים על פי התקן האמריקני, מעלים פי שישה עד פי 27 את קצב הופעתם של חיידקים עמידים.
המומחים מוחים, אם כן, כנגד שימוש יתר באנטיביוטיקה, הן של האדם והן של המשק החקלאי. אך יש לזכור כי כל שימוש, ולו האחראי ביותר, מעורר בסופו של דבר את הופעתם של זנים עמידים. לכן בכל מקרה חשוב לקדם את פני רעת העמידות. אחת הדרכים היא התמדה ב"מירוץ החימוש" - להמשיך ולפתח תרופות חדשות כדי להרוויח זמן, עד להופעת עמידות כלפיהן. מתברר כי עד אמצע שנות השמונים נראתה תמיד באופק תרופה אנטיביוטית חדשה המצפה לאישור לתחילת שימוש, ואילו עכשיו חברות התרופות אינן מתאמצות עוד. גם מ"החלונות הגבוהים", הממשלתיים, אין "מזרימים" עוד די כספים לעידוד חקר העמידות ולסיוע בפיתוח תרופות אנטיביוטיות חדשות. ראוי להשקיע מאמץ מיוחד בפיתוחן של אנטיביוטיקות מלאכותיות, שעבורן אין מלכתחילה בטבע מקור להפצת עמידות - אותם חיידקים מייצרי אנטיביוטיקה טבעית.
אחת הגישות להתמודד עם בעיית האנזימים המקנים עמידות היא שימוש במעכבים של אותם אנזימים מפרקי אנטיביוטיקה. גישה זו נשאה פרי בקבוצת האנזימים מפרקי הפניצילין - נמצא מעכב המתקשר אליהם ומנטרל את פעילותם. גלולות המכילות את הפניצילין בתוספת החומר המעכב משווקות בבתי המרקחת - צעד נוסף במירוץ החימוש. אולם האויב כבר הספיק להגיב: כבר הופיעו זני חיידקים העמידים לא רק בפני התרופה האנטיביוטית אלא גם בפני המעכב המוסף.
זהו, ללא ספק, עניין מתיש, יקר ומסוכן, וכל סיוע נדרש. חשוב לצמצם עד למינימום את השימוש באנטיביוטיקה, ובד בבד להקפיד הקפדת יתר על חיטוי ועיקור, כדי להפחית את הסכנה של העברת חיידקים פתוגניים, במיוחד בבתי החולים. ואולי גם ראוי לשנס מותניים ולנסות ליצור תרכיבי חיסון נגד חיידקים בעייתיים במיוחד.
יש לחשוב גם על נקיטת צעדים מתוחכמים לרענון יעילותן של תרופות האנטיביוטיקה. למשל, הטטרציקלינים איבדו הרבה מזוהרם בגלל הופעת עמידות ברבים מבין מיני החיידקים שנודעו בעבר ברגישותם לטטרציקלינים. עמידות זו נובעת במקרים רבים ממנגנון הדחה יעיל של טטרציקלינים מתוך החיידק החוצה. מחקרים נערכים עתה למציאת מולקולה שתחסום את החלבון הפועל כמשאבה מסלקת טטרציקלינים, וכך להחזיר לטטרציקלינים את זוהרם.
התרופה החשובה ביותר כיום נגד חיידק השחפת היא איזונאזיד. והנה בשנים האחרונות הופיעו זנים עמידים בפניה. ויליאם ג'ייקובס (Jacobs) ועמיתיו ממכללת אלברט איינשטיין לרפואה בארה"ב עורכים מחקרים אינטנסיביים כדי לרדת לשורש הבעיה. החוקרים מקווים כי היכרות יסודית של מנגנון העמידות תסייע למצוא דרך יעילה לנטרל אותו, וכך לרענן את יעילותה של התרופה למחלת השחפת, - מחלה קשה הממיתה באטיות. האם בעקבותיהם ילכו חוקרי העמידות בפני תרופות אנטיביוטיות?
נראה כי הרפואה ניצבת כיום בצומת דרכים בהיסטוריה המהוללת של התרופות האנטיביוטיות, שכה היטיבו בעבר עם האנושות: דרך אחת מובילה לתנופה חדשה, והדרך האחרת - לכניעה בפני העמידות ולניוון. אם כך, אולי לא "קץ האנטיביוטיקה", כגרסת הניוזוויק, אלא "האנטיביוטיקה - לאן?"