הקדמה
כמוטקסיס, כלומר התגובה של תאים לגרויים כימיים ע"י תנועה (משיכה או דחייה), הוא אחד מהתהליכים הבסיסיים ביותר בטבע לתקשורת בין תא לתא או בין תא לסביבה. תהליך זה מובן יחסית טוב יותר בחיידקים היכן, שבתנאים רגילים, הוא מקרב אותם לחומרים מועילים (אטרקטנטים) ומרחיק אותם מחומרים מזיקים (רפלנטים) [1], ובתנאי עקה משמש לתקשורת בין-תאית [3,2]. מערכת הכמוטקסיס בחיידקים היא המערכת הנחקרת ביותר ששייכת למשפחה של מערכות בקרה דו-רכיביות (two-component regulatory systems), שהיא משפחה חדשה יחסית של מערכות העברת אותות (signal-transduction systems) הנפוצה מאד בחיידקים, ובשנים האחרונות התגלתה אף בצמחים ושמרים [4]. מערכות אלה מורכבות מחיישן (sensor) שהוא קינאזה העוברת זירחון עצמי על שייר היסטידין (kinase histidine) , ומבקר תגובה (response regulator) אשר, כחלק מהעברת האות, מזדרחן על שייר אספרטט ע"י החיישן. המיוחד בסוג זה של מערכות, שהוא מספק מבחר אדיר של מעגלי העברת אותות, שכולם עשויים מאותם שני אלמנטים (כ50- מעגלים כאלה כבר ידועים). התקדמות ענק נעשתה בעשור האחרון בהבנת המנגנון של כמוטקסיס בחיידקים, החל מתקופה, שבה מנגנון הכמוטקסיס ומנגנון העברת האותות לא היו ידועים, וכלה בתקופה, שבה התהליכים המעורבים בהם ידועים ומוגדרים. במאמר זה אני מסכם, מנקודת מבט סובייקטיבית, את ההתקדמות שנעשתה בהבנת הבקרה של כמוטקסיס בחיידקים. מאחר ובקרת כמוטקסיס מובנת כיום ביותר ב-Escherichia coli ו-Salmonella typhimurium, המאמר יתרכז בסוגים אלה. בקרת כמוטקסיס בחיידקים היא בקרת כיוון הסיבוב של השוטונים
חיידקים מסוגם של E. coli ו-S. typhimurium. שוחים ע"י סיבוב השוטונים שלהם. כל שוטון מונע ע"י מנוע, שעד תחילת השנה נחשב כמנוע הקטן ביותר בתבל. (כיום ידוע, שהתואר הזה שייך למנוע ה-F1-ATPase - מקור [5]). מנוע השוטון מסתובב במהירות אדירה (15,000 סיבובים בדקה) והוא מונע ע"י זרם של פרוטונים, 1,000 פרוטונים לסיבוב. יש לו אפילו "תיבת הילוכים", או "מתג", אשר מקבל מידע מהקולטנים של מערכת הכמוטקסיס ומשנה בהתאם את כיוון הסיבוב [6]. פרט לזהות החלבונים, מהם מורכב המתג, מעט מאד ידוע על המבנה או על מנגנון הפעולה שלו. התוצאה של סיבוב השוטונים נגד כיוון השעון (counterclockwise או CCW; הכיוון מוגדר מנקודת מבט חיצונית לתא) היא שחיה בקו ישר, בעוד שהתוצאה של סיבוב עם כיוון השעון (clockwise או CW) או עצירה קצרה היא תנועת סחרור קצרה ומהירה, שבסופה התא שוחה בכיוון חדש [7]. באופן כזה, ע"י מודולציה מתאימה של כיוון סיבוב השוטונים, החיידקים נמשכים לאטרקטנטים ונמנעים מרפלנטים. כך השאלה, כיצד נעשית הבקרה על תהליך הכמוטקסיס בחיידקים שוחים, מצטמצמת לשאלה, כיצד נעשית הבקרה על כיוון הסיבוב של השוטונים. למנוע השוטון יש כיוון סיבוב מועדף (defauIt)
שתי גישות עיקריות ננקטו כדי לגלות את מנגנון הבקרה של כיוון סיבוב השוטונים: גישת תא שלם וגישת הפחתה. גישת התא השלם התבססה על בידוד מוטנטים בכמוטקסיס ואיפיון ההתנהגות שלהם [8]. גישת ההפחתה התבססה על הכנסת חלבוני כמוטקסיס מנוקים לתוך מעטפות תאי חיידקים, שרוקנו מהציטופלסמה שלהם, ובדיקת השפעת החלבונים על כיוון סיבוב השוטון [9]. שתי הגישות הובילו למסקנה, שלמנוע השוטון יש כיוון מועדף, CCW. כך בגישת התא השלם, השוטונים של מוטנט, שהוצאו ממנו כל הגנים המקדדים לחלק מהקולטנים שבממברנה ולכל חלבוני הכמוטקסיס שבציטופלסמה, הסתובבו אך ורק CCW. כך גם בשיטת ההפחתה, השוטונים של מעטפות "ריקות" של זן הבר הסתובבו אך ורק CCW למרות שמבחינה מכנית יכלו גם להסתובב בכיוון האחר. במילים אחרות, המנוע תמיד מסתובב CCW אלא אם כן הוא מקבל אות לעשות את ההיפך. (לאחרונה נמצא שזה נכון רק בתחום הטמפרטורות 20-37°C. בטמפרטורות נמוכות יותר, בעיקר בטמפרטורות קרובות לאפס, הרמה האנרגטית של מצב CW של המנוע יורדת, וכתוצאה מכך הסיבוב יכול להיות בשני הכיוונים, כאשר המעבר ביניהם הוא ספונטני [10]. האות לשינוי כיוון הסיבוב
בשלב הבא נתגלתה, גם בגישת התא השלם וגם בגישת ההפחתה, זהות האות שגורם לסיבוב CW, כלומר המוליקולה אשר מגיבה עם המתג בבסיסו של המנוע ומביאה לסיבוב CW. זהו חלבון הכמוטקסיס CheY (שמם של כל חלבוני הכמוטקסיס מתחיל בקידומת Che) כך, בגישת התא השלם, שיטות גנטיות (second site suppression analysis) רמזו שקיימת אינטראקציה בין CheY למתג [6, 11 לסקירות], וייצור יתר של CheY בזני חיידקים, החסרים את כל חלבוני הכמוטקסיס הציטופלסמטיים וחלק מהקולטנים, גרם לסיבוב CW, [12, לסקירה ראה 13]. בגישת ההפחתה, CheY מנוקה שהוכנס לתוך מעטפות חיידקים ריקות גרם לסיבוב CW בחלק מהמעטפות [14]. העדרותם של חלבוני הכמוטקסיס בחיידקים קשלמים והעדר הציטופלסמה במעטפות העידו, שהאינטראקציה בין CheY והמתג היא ישירה. בקרת שינוי כיוון הסיבוב
לאחר זיהוי CheY כאות לסיבוב CCW נשאלה השאלה, כיצד נעשית הבקרה על פעילותו. ממצאים שנתקבלו בשתי קבוצות מחקר באופן בלתי תלוי הראו, ש-in vitro, חלבון CheY מזדרחן ע"י הקינאזה CheA, שהיאhistidine kinase, הקשורה לקולטנים באמצעות חלבון אחר (CheW). חלבון CheY המזורחן (CheYP) מאבד את הזרחן באופן ספונטני או, הרבה יותר מהר, ע"י CheZ שהוא פוספאטאזה ספציפית [16,15] (ציור 1) (המושג פוספאטאזה מובא כאן במובנו הרחב). זה העלה את הסברה, שפעילותו של CheY מבוקרת ע"י זירחונו. ואמנם, זירחונו של CheY ע"י CheA בתוך מעטפות תאים שבמכוון הכילו, בנוסף ל-CheY ו-CheA שיירים של ציטופלסמה נטולת חלבוני כמוטקסיס, גרם להגברת סיבוב ה-CW - מקור [17]. סיבוב CW הוא, קרוב לוודאי, התוצאה הסופית של מספר שלבים ברמת המתג. מי מהם הוא זה, המושפע מהזירחון של CheY? השלב הסביר/הפשוט ביותר הוא הראשון, כלומר הקישור של CheY למתג. שיבוט הגנים, המקודדים לחלבוני המתג (FliG, FliM, ו-FliN), איפשרו לבדוק זאת. ואמנם נמצא, שמתוך שלושת החלבונים שמרכיבים את המתג, רק FIiM קושר את CheY, והקישור גדל פי 20 בתנאים שבהם CheY מזורחן [18]. כל המימצאים האלה יחד הוכיחו ש-CheY נקשר למתג, שאתר הקישור הוא על FliM, שהקישור מבוקר ע"י זירחון CheY, ושהתוצאה של הקישור היא סיבוב CW. 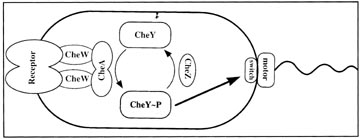
ציור 1: תרשים מפושט של העברת האות הכמוטקטי בחיידקים, המדגיש את התפקיד המרכזי של CheY בבקרת התהליך. לצורך הפשטות, החלבונים CheR ו-CheB, המשתתפים בתהליך ההסתגלות לגרוי, אינם כלולים בתרשים. התרשים אינו לפי קנה מידה.
בקרה גלובלית ע"י זירחון CheY
אם רמת הזירחון של CheY מווסתת את תהליך הכמוטקסיס, הרמה הזו צריכה להיות מושפעת ומבוקרת ע"י גרויים כמוטקטיים. הבקרה יכולה להיעשות על קצב הזירחון, קצב הסרת הזרחן, או שניהם. ואמנם נמצא in vitro, שבנוכחות CheW והקולטן המתאים (ציור 1), הזירחון של CheY ע"י הקינאזה CheA מבוקר ע"י גרויים כמוטקטיים [19], והתוצאה היא התנתקות CheY מ-CheA - מקור [20]. הבקרה של פעילות הפוספאטאזה CheZ נתגלתה רק לאחרונה, כאשר נמצא, שהאינטראקציה בין ,CheY ל-CheZ תלויה ברמת הפוספורילציה של CheY ושמולקולת CheZ נקשרת ל-CheYP בשניים-שלושה סדרי גודל (!) טוב יותר מאשר ל-CheY - מקור [21]. יתר על כן, נמצא ש-CheZ הוא דימר (48kDa) אשר עובר אוליגומריזציה נוספת (יתכן דימריזציה של הדימר) כתוצאה מקישור ל-CheYP - מקור [22], מה שהציע שהאוליגומריזציה מבקרת את פעילות הפוספאטאזה של CheZ. כדי לבדוק אפשרות זו, נבדקו חלבוני CheZ מוטנטיים חסרי פעילות פוספאטאזה, אך בעלי יכולת קשירה נורמלית ל-CheY. חלבונים אלה לא עברו אוליגומריזציה בעקבות קישורם ל-CheYP, מה שהצביע על קשר בין הפעלת הפוספאטזה והאוליגומריזציה [23]. כדי להבחין בין סובב למסובב, כלומר האם האוליגומריזציה מפעילה את הפוספאטאזה או האם היא תוצאה של הפעלת הפוספאטאזה, הושוותה הקינטיקה של הסרת הזרחן מ- CheYP עם הקינטיקה של האוליגומריזציה. מאחר ותהליך העברת האות מסתיים בתוך עשירית השניה, הקינטיקות נבדקו במכשיר stopped flow, כאשר רמת הזרחן על CheY נמדדת באמצעות פלורסצנסיה של שייר טריפטופאן, הקרוב לאתר הזירחון, ודרגת האוליגומרציזציה ע"י סמן פלורסצנטי הקשור ל- CheZ. נמצא, שהיה עיכוב של 100-50 מילישניות בתהליך הסרת הזרחן, אשר במהלכו CheZ עבר אוליגומריזציה [24]. עיכוב כזה לא נמצא ב-CheZ שפעילותו קונסטיטוטיבית. כך שהמסקנה היא שהאוליגומריזציה מפעילה את CheZ (ציור 2). כפי שמראה הציור, יש לנו כאן מערכת מיחזור חסכונית שבה הצורה הפעילה והלא פעילה של CheY (וכן גם הצורה הפעילה והלא-פעילה של CheZ) יכולות להיווצר זו מזו מספר רב של פעמים. נראה, אם כן, ש-CheY הוא מרכז הבקרה של העברת המידע הכמוטקטי: רמת הזירחון של CheY קובעת את מידת הקישור של CheY לקינאזה CheA לפוספאטאזה CheZ, ולחלבון המתג FliM. יתר על כן, היא מכתיבה את מידת האוליגומריזציה של CheZ וכתוצאה מכך את רמת פעילות הפוספאטאזה. 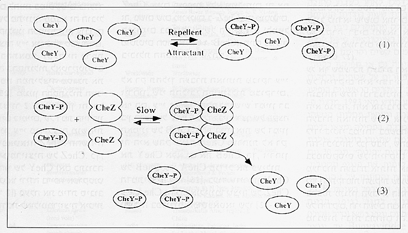
ציור 2: מנגנון סיום העברת האות ע"י CheZ. צורות מליאות וריקות מייצגות מוליקולות פעילות ולא פעילות בהתאמה. לצורך הבהירות, התרשים ניתן בפשטות יתר. הרכב האוליגומר, כפי שהוא מצוייר, אינו משקף בהכרח את המבנה או ההרכב האמיתי של האוליגומר.
סיום התגובה הכמוטקטית
כבר בתחילת שנות השבעים נמצא, שכמו ברובן של מערכות החישה, כך גם בכמוטקסיס של חיידקים, ישנה הסתגלות (adaptation) לגרוי. כך, כמו שאנו מסתגלים לריח מסויים ומפסיקים לחוש בו אחרי זמן מה על אף שהוא ממשיך להיות קיים, כך גם חיידקים מפסיקים לחוש אחרי זמן מה בכימיקל מושך או דוחה, שריכוזו נשאר קבוע. תהליך ההסתגלות הוא הכרחי למערכת, שמגיבה לשינויים בריכוז הכימי, כי הוא מאפשר למערכת לחוש שינויים חדשים המתרחשים על גבי הרמה הקבועה של הגרוי. ישנם שני מנגנוני הסתגלות בכמוטקסיס של חיידקים. אחד מהם נמצא בשלהי שנות השבעים בעקבות אבחנתו של ג'וליוס אדלר, אבי השטח של כמוטקסיס בחיידקים, שחיידקים אוקסוטרופיים למתיונין מפסיקים להיות כמוטקטים בהעדר תוספת חיצונית של מתיונין. ממצא זה הוביל לתגלית, שחלק מקולטני הכמוטקסיס עוברים מתילציה ודמתילציה ע"י אנזימים ספציפיים, CheR ו-CheB בהתאמה, ושעלייה ברמת המתילציה מביאה להסתגלות לאטרקטנטים בעוד שירידה ברמת המתילציה מסגלת את התא לרפלנטים [25]. מנגנון ההסתגלות השני הוא זה המובא בציור 2. לפי מנגנון זה, כל מודולציה, ע"י גרויים כימיים, של רמת הזירחון של CheY מתאזנת ע"י מודולציה מושהית של פעילות הפוספאטאזה CheZ. ההשהיה נגרמת ע"י האוליגומריזציה של CheZ. כך, עליה ברמת הזירחון של CheY (אם כתגובה לעליה בריכוז רפלנט או ירידה בריכוז אטרקטנט (תהליך 1 בציור 2)) מעלה את מידת סיבוב ה-CW ובמקביל גורמת לאוליגומריזציה איטית (תהליך 2 בציור 2) אשר התוצאה שלה היא עליה ברמת פעילות הפוספאטאזה וסיום הסחת הסיבוב לכיוון CW (תהליך 3). ולהיפך, ירידה ברמת הפוספורילציה (בתגובה לעליה בריכוז אטרקטנט או ירידה בריכוז רפלנט) מסיטה את סיבוב השוטונים לכיוון של ירידה ברמת ה-CW ובמקביל גורמת לדיסוציאציה איטית של האוליגומר של CheZ ולהקטנת פעילות הפוספאטאזה. כך שיש כאן מנגנון היזון חוזר (feedback) של הסתגלות אשר מבטיח, שרמת הזירחון של CheY תחזור קרוב לרמת הזירחון שהיתה לפני הגרוי הכמוטקטי, ושבהתאמה אופן השחיה של החיידק יחזור לזה, שהיה לפני הגרוי, למרות המשך נוכחותו של הכימיקל המגרה. נראה, ששני מנגנוני ההסתגלות, זה שעובד דרך שינויים ברמת המתילציה של הקולטן וזה שעובד דרך אוליגומריזציה של CheZ, אינם חופפים אלא משלימים זה את זה, משום שגם מוטנטים ב-CheZ וגם מוטנטים, הפגומים במתילציה של הקולטנים (למשל מוטנטים חסרי CheR ו-CheB) הינם פגועים ביכולת ההסתגלות שלהם.לא רק תהליך העברת האותות מבוקר ע"י זירחון:שני תהליכי ההסתגלות מבוקרים, אף הם, ע"י זירחון. הסתבר, שיש דמיון רב בין הרצף של CheY כולו לבין הרצף של הקצה האמיני של CheB. אחת התוצאות של דמיון זה היא שהקינאזה CheA מזרחנת לא רק את CheY אלא גם את CheB. כך, זירחון של CheB ע"י CheA מגדיל את פעילות הדמתילציה שלו [26], בעוד שזירחון CheY ע"י CheA גורם לאוליגומריזציה של CheZ ולעליה בפעילות הפוספאטאז שלו [24-22].
סיכום
התמונה המצטיירת מהמחקרים, שנסקרו כאן, היא ש-CheY הוא אתר הבקרה המרכזי בתהליך העברת האותות בכמוטקסיס, וזירחון היא פעילות הבקרה העיקרית. הזירחון העצמי של הקינאזה CheA, בתגובה לגרוי כמוטקטי, פותח מספר סדרות של תהליכים [27]: CheY מזדרחן ע"י CheA וכתוצאה מכך CheY-P ניתק מהקומפלכס הרבעוני receptor:CheW:CheA:CheY (ציור 1). חלבון המתג FliM והפוספאטאזה CheZ מתחרים על CheYP. קישור ל-FliM גורם לסיבוב CW של השוטונים, ואילו קישור ל-CheZ גורם לאוליגומריזציה מושהית של הפוספאטאזה, הפעלתה, הסרת הזרחן מ-CheYP, וסיום התגובה הכמוטקטית. במקביל, הקינאזה מזרחנת לאט גם את CheB, רמת המתילציה של הקולטנים יורדת, והתגובה הכמוטקטית מסתיימת גם ברמת הקולטנים. קרוב לוודאי שישנם אתרים ותהליכים נוספים של בקרה. רבים נמצאו, אך עדיין לא ידוע האם הם מעורבים פיסיולוגית וכיצד [לסקירה - רפרנס 27]. על אף שמערכת העברת האותות בכמוטקסיס של חיידקים היא יחודית במהירות התגובה הגבוהה שלה וברבגוניות של הגרויים, להם היא מגיבה, היא אוניברסלית מבחינת מנגנון העברת האותות שלה. אוניברסליות זו באה לידי ביטוי במיוחד במשפחת מערכות הבקרה הדו-רכיביות. לכן סביר, שהבנת מנגנוני הבקרה בכמוטקסיס של חיידקים ישפכו אור גם על מערכות העברת אותות אחרות. אם לשפוט לפי ההתקדמות הענקית שנעשתה בעשור האחרון בהבנת מנגנון העברת האותות בכמוטקסיס של חיידקים, הרי השנים הבאות צופנות התפתחויות מרגשות רבות בתחום זה.
References
- Adler, J. (1976). The sensing of chemicals by bacteria. Scient. Amer. 234(4), 40-47.
- Budrene, E.O. and Berg, H.C. (1991). Complex patterns formed by motile cells of Escherichia coli. Nature 349, 630-633.
- Blat,Y. and Eisenbach, M. (1995). Tar- dependent and -independent pattern formation by Salmonella typhimurium. J. Bacteriol. 177, 1683-1691.
- Alex, L.A. and Simon, M.I. (1994). Protein histidine kinases and signal transduction in prokaryotes and eukaryotes. Trends Genet. 10, 133-138.
- Noji, H., Esuda, R., Yoshida, M. and Kinosita, K. (l997). Direct observation of the rotation of F1-ATPase. Nature 386, 299-302.
- Macnab, R.M. (1995). Flagellar switch. In: Two-Component Signal Transduction (J.A. Hoch and T.J. Silhavy, eds.), pp.181- 199. American Society for Microbiology, Washington , DC .
- Eisenbach, M. (1990). Functions of the flagellar modes of rotation in bacterial motility and chemotaxis. Mol. Microbiol. 4, 161-167.
- Parkinson, J.S. ( 1981). Genetics of bacterial chemotaxis. Soc. Gen. Microbiol. Symp. 31, 265-290.
- Eisenbach, M. and Matsumura, P. (1988). In vitro approach to bacterial chemotaxis. Botan. Acta 101, 105-110.
- Turner, L.,Caplan,S.R. and Berg, H.C. (1996). Temperature-induced switching of the bacterial flagellar motor. Biophys. J. 71, 2227-2233.
- Barak, R. and Eisenbach, M. (1996). Regulation of interaction between signaling protein CheY and flagellar motor during bacterial chemotaxis. Curr. Top. Cell. Reg. 34, 137- 158.
- Clegg, D.O. and Koshland, D.E. (1984). The role of a signaling protein in bacterial sensing: Behavioral effects of increased gene expression. Proc. Natl. Acad. Sci. U.S.A. 81,5056-5060.
- Eisenbach. M. (1991). Signal transduction in bacterial chemotaxis. Modern Cell Biol. 10, 137-208.
- Ravid, S., Matsumura, P. and Eisenbach.M. (l986). Restoration of flagellar clockwise rotation in bacterial envelopes by insertion of the chemotaxis protein CheY. Proc. Natl. Acad. Sci. U.S.A. 83, 7157-7161.
- Hess, J.F., Oosavva, K., Kaplan, N. and Simon, M.1. (1988). Phosphorylation of three proteins in the signaling pathway of bacterial chemotaxis. Cell 53, 79-87.
- Wylie, D., Stock, A., Wong, C.-Y. and Stock, J. (1988). Sensory transduction in bacterial chemotaxis involves phosphotransfer between Cheproteins. Biochem. Biophys. Res. Commun. 151, 891- 896.
- Barak, R. and Eisenbach, M. (1992). Correlation between Phosphorylation of the chemotaxis protein CheY and its activity at the flagellar motor. Biochemistry 31, 1821-1826.
- Welch, M., Oosawa, K., Aizawa, S.-I. and Eisenbach, M. (1993). Phosphorylation-dependent binding of a signal molecule to the flagellar switch of bacteria. Proc. Natl. Acad. Sci. U.S.A. 90, 8787-8791.
- Borkovich, K.A., Kaplan, N., Hess, J.P. and Simon, M.I. (1989). Transmembrane signal transduction in bacterial chemotaxis involves ligand-dependent activation of phosphate group transfer. Proc. Natl. Acad. Sci. U.S.A. 86, 1208-1212.
- Schuster, S.C., Swanson, R.V., AIex, L.A., Bourret, R.B. and Simon, M.I. (1993). Assembly and function ofa quaternary signal transduction complex monitored by surface plasmon resonance. Nature 365, 343-347.
- Blat, Y. and Eisenbach, M. (1994). Phosphorylation-dependent binding of the chemotaxis signal molecule CheY to its phosphatase, CheZ. Biochemistry 33, 902-906.
- Blat,Y. and Eisenbach, M. (1996). Oligomerization of the phosphatase CheZ upon interaction with the phosphorylated form of CheY, the signal protein of bacterial chemotaxis. J. Biol. Chem. 271, 1226-1231.
- Blat, Y. and Eisenbach, M. ( 1996). Mutants with defective phosphatase activity show no phosphorylation-dependent oligomerization of CheZ, the phosphatase of bacterial chemotaxis. J. Biol. Chem. 271, 1232-1236.
- Blat, Y., Gillespie, B., Dahlquist, F.W. and Eisenbach, M. (1997). Delayed phosphatase activation: potentially novel adaptation in bacterial chemotaxis. Submitted.
- Springer, M.S., Goy, M.F. and Adler, J. (1979). Protein methylation in behavioral control mechanisms and in signal transduction. Nature 280. 279-284.
- Lupas, A. and Stock, J. ( 1989). Phosphorylation of an N terminal regulatory domain activates the CheB methylesterase in bacterial chemotaxis. J. Biol. Chem. 264, 17337-17342.
- Eisenbach, M. (1996). Control of bacterial chemotaxis. Mol. Microbiol. 20, 903-910.