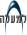מבוא
מי ישרוד על פני כדור הארץ לאחר שואה גרעינית? מירב החוקרים שנתנו דעתם על שאלה זו מסכימים ביניהם שקרוב לודאי הוא שממלכת החרקים היא זו
שתשרוד בצורה זו או אחרת ותאכלס את עולמנו החרב. חוקרים אלה לא נתנו כנראה את דעתם לאורגניזמים היציבים ביותר לקרינה שנתגלו עד היום -
חיידקי משפחת ה-Deinococcaceae שלהם כושר עמידות מופלא מפני סוגי קרינה שונים.כיצד נתגלתה משפחת חיידקים זו? תהליך העיקור של קופסאות שימורים, במפעל לשימורי בשר במדינת אורגון בארה"ב, כלל הקרנה בקרני גמא. באחד ממחזורי הייצור בשנת 1956 נמצאו מספר קופסאות שהתקלקלו. מיקרוביולוג בשם Anderson בודד מקופסאות אלה חיידק קרקע גראם חיובי, שאינו יוצר נבגים, הנותן מושבות ורודות בגידול על אגר. לחיידק זה היה כושר עמידות בלתי רגיל לאפקטים הקטלניים והמוטגניים של קרינת מיננת וקרינת UV. בשנת 1961, לאחר שנלמדו תכונותיו המיוחדות של חיידק זה כינה Anderson אותו בשם Radiodurans (זן R1) ובשנת 1995 זכה החיידק למקום של כבוד בספר השיאים של גינס (Guinness Book of Records) כ"חיידק הקשוח ביותר עלי אדמות".
במהלך השנים שעברו מהבידוד הראשוני היו בידודים נוספים של החיידק בארה"ב וביפן ויותר מאוחר הוסב שמו ל-Deinococcus. (Deinos פירושו ביוונית מוזר, בלתי רגיל). ב-1980 בודד זן נוסף של החיידק כגורם זיהום של בית חולים באונטריו, קנדה. ל-DNA של זן זה שכונה Deinococcus radiodurans SARK הייתה הומולוגיה של 33% לזן R1. גם לחיידק זה הייתה עמידות מופלאה לקרינה מייננת, לקרינת UV ולחומרים מוטגניים. תכונות אלה, כמו גם המבנה המיוחד של דופן התא ורצף הבסיסים של ה-16S ribosomal RNA, המשותפות גם למינים האחרים של משפחה זו שבודדו במשך השנים, D. radiophilus, D. proteolyticus ו-D. radiopugnas. מין נוסף במשפחה זו, Deinobacter grandis, אינו נקד (Coccus) כשאר חברי המשפחה, אלא מתג, אולם גם בגנוטיפ וגם בפנוטיפ אין הוא נבדל משאר חברי המשפחה. אם נסכם מבחינת קלסיפיקציה, בגנוס Deinococcus ישנם ארבעה חברים, חבר אחד בגנוס Deinobacter ויחד הם מהווים את אחת מעשר משפחות החיידקים הידועות, והקטנה שבהן. מבחינה אבולוציונית זוהי משפחה יחודית המרוחקת מ-Escherichia coli באותה מידה כמו מ-Bacillus subtilis.
תכונותיו המיוחדות של החיידק ומבנהו המיוחד, עליו נתעכב מעט בהמשך, הביאו למספר השערות לגבי מקורו האבולוציוני, חלקן נראה כאילו לקוח מספרות המדע הבדיוני. Berkner ו-Marshal הציעו בשנת 1964 שתכונותיו המיוחדות של הדינוקוקוס נבעו מלחצי סלקציה לעמידות לרמה מוגברת של רדיקלים חופשיים ולתנאי קרינה קיצוניים ששררו באווירת כדור הארץ בפרה-היסטוריה. חוקרים אחרים ובינם Hoyle ו-Wickramasinghe טענו בשנת 1981 שהדינוקוקוס ניצל את תכונותיו המיוחדות לשרוד בתנאי הריק וקרינת ה-UV הקיצונית השוררים בחלל החיצון. לאחרונה טענו Minton ו-Daly (1995) שרמות קרינה כה גבוהות שלהן עמיד הדינוקוקוס לא שררו מעולם בעולמנו, גם לא בתחילת הווצרותו. הדינוקוקוס לדעתם פיתח עמידות לתנאי יובש קיצוניים, תנאים שאף הם יוצרים פרגמנטציה של ה-DNA. העמידות לקרינה היא לכן תוצאה מקרית מהעמידות לתנאי יובש. במה מתבטאת עמידותו המיוחדת של הדינוקוקוס לקרינה? חשיפה של בני אדם למנת קרינה מיננת של 600-500 ראד (או 5-6 Gy ביחידות S.I.) תסתיים במותם הכמעט ודאי. מנת הקרינה הנדרשת לעיקורו של הדינוקוקוס היא 50,000-60,000 Gy ולחיידק עמידות גבוהה למנות קרינה של 5000-30000 Gy כשה-D37 הוא כ-17500 Gy. איור מס' 1 מדגים את כשר עמידותו הגבוה של הדינוקוקוס זן הבר - R1, לקרינה מיננת, קרינת UV, ולתרכובת האלקילתית (alkylating agent) מיטומיצין C (MMC - mitomycin C) באיור מודגמת גם התנהגותם של מספר מוטנטים של החיידק עליהם נתעכב בהמשך. בהשוואה, בקנה המידה של האיור ייפול גרף האינקטיבציה של E. coli על ציר ה-Y.
איור 1: חיוניות הדינוקוקוס לאחר השראת נזקי DNA |
 |
מבנה החיידק
כאמור במבוא, רב חברי משפחת ה-Deinococcaceae הם נקדים גראם חיוביים הנותנים מושבות בגוון ורוד. למרות היותם גרם חיוביים יש לחיידקי
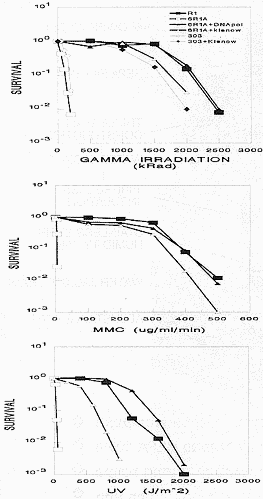
המשפחה מבנה דופן מיוחד במינו שלא תואר לגבי אף אחת ממשפחות החיידקים הגראם חיוביים האחרות (איור 2). לדופן זו ארבע שכבות מחוץ
לממברנת התא ולכל אחת מהן מבנה בלתי רגיל. הממברנה החיצונית והפנימית מופרדות ע"י שתי שכבות. הראשונה שכבת פוליגליקן מחוררת המכילה
אלנין, חומצה גלוטמית, גליצין ו-L-אורניתין (במקום הליזין או החומצה הפימלית הנפוצות יותר). החרירים שבשכבה זו הם בקוטר 10 nm. מבנה
השכבה השניה הקרויה שכבת המחיצות (Compartmentalized layer) אינו ידוע. הממברנה החיצונית מכילה ליפידים דומים לאלה שבממברנה הפנימית
אך ביחסים שונים. השכבה השלישית קרויה HPI (Hexagonal Packed lntermediate) ומכילה חלבון המאורגן בתת-יחידות משושות. השכבה הרביעית
שמעליו היא שכבה עבה של סוכרים דחוסים. את הדופן הייחודית הזאת ניתן לחלק לשני חלקים (איור 2): השכבה המחוררת והמעטפת. המעטפת הדומה
בכמה ממאפיניה למעטפות האצות הכחוליות, עוטפת בדרך כלל שני תאים ונוצרת על גבי תאי הבת לאחר החלוקה. גם הליפידים של משפחת הדינוקוקוס מיוחדים ושונים מהמוכר במשפחות חיידקים אחרות. תרומתה של הדופן לעמידות הגבוהה של החיידק אינה ברורה וכך המצב גם לגבי מספר מולקולות תוך-תאיות הנמצאות בריכוז גבוה. אחת מהמולקולות האלה היא הקרוטנואיד - הפיגמנט האדום של החיידק שתחילה יוחסה לו חשיבות בהגנה בפני קרינה, אולם מוטנטים חסרי צבע שנתגלו היו יציבים לקרינה כמו גזע הבר.
לחיידק תכולת סולפידרילים גבוהה ובודד גם "פקטור" סולפידרילי שהקנה כביכול הגנה בפני קרינה גם ל-E coli. לחיידק גם ריכוז גבוה במיוחד של מנגן וגם לו יוחסה חשיבות בהגנה בפני קרינה בגלל יכולתו להפחית את רמת תוצרי ההקרנה ב-UV, במיוחד דימרים של תימין. מנגן מעלה גם את רמת הסופראוקסיד דיסמוטז (SOD) בתאי הדינוקוקוס. אנזים זה תוקף רדיקלים חופשיים ועי"כ, הניחו החוקרים, מקטין את הנזק ל-DNA. אולם כנגד השערות אלה קיימת העובדה הפשוטה שלאחר מנת קרינת UV של 500 J/m2, 1% מהתימין בתא מופיע כדימרים הן בדינוקוקוס והן בחיידקים אחרים. אך בעוד לחיידקים האחרים מנה זו היא מנה ממיתה, הדינוקוקוס עמיד בפניה. קשה לכן לדעת האם לכל המולוקולות הנ"ל תפקיד בעל משמעות בהגנה בפני נזקי DNA.
איור 2: מבנה המעטפת של הדינוקוקוס: לדינוקוקוס מבנה מעטפת ייחודי בעולם החיידקים. מעטפת זו מקנה לו קשיחות ודורשת אמצעים מיוחדים על מנת למצות את מוהל התאים.
נזקי הקרינה והתרכובות האלקילתיות
כבר מתחילת המחקר בדינוקוקוס היה ברור לחוקרים שעמידותו של הדינוקוקוס לנזקי קרינה ולצורות אחרות של נזקים ל-DNA נובעת ממנגנוני תיקון
נזקי DNA יעילים ביותר. מדידות של מספר הפגיעות ב-DNA של החיידקים המוקרנים או המטופלים הראו רמת נזק גבוהה ביותר, כזו המצופה ממנות
הקרינה העצומות או מהחשיפה המסיבית לכימיקלים השונים. רמות נזק אלה מסוגל הדינוקוקוס לתקן כשמנגנון תיקון יעיל זה עדיין לא מובן די
צרכו.מה הנזק הנגרם ע"י חומרים אלקילתיים, קרינת UV וקרינה מיננת? נתעכב על כך בקצרה. החומרים האלקילתיים הם תרכובות בעלות אפיניות נוקלאופילית הנקשרות בעיקר לחנקן N7 של גואנין או N3 של אדנין המהווים אתר נוקלאופילי. בהיותו גורם מונו-וביפונקציונלי יכול ה-MMC להקשר לכל אתרי החנקן והחמצן המתאימים ועי"כ נגרם נזק למבנה הסלילי ונוצרים קשרים רבים בין גדילי ה-DNA וההכפלה והשיעתוק מעוכבים לחלוטין. קרינת UV, בתדירות גבוהה (200-290 nm) נבלעת בקלות ע"י DNA ו-RNA וגורמת נזק לשניהם ע"י יצירת דימרים של בסיסים ויצירת תוצרי קרינה אחרים. דימרים אלה גורמים לעיבוי ולהפרעות במבנה הסלילים וכתוצאה לעיכוב הכפלת ה-DNA. הדימרים אינם מוגבלים לתימין בלבד אלא יכולים לחול גם בין מולקולות ציטוזין. תוצרי קרינה נוספים הם הדימרים פירימידין-פירימידין (6-4) המהווים כ-17% מכלל הנזק ל-DNA ומשתווים לאחוז הדימרים של תימין, והתימין-גליקול הנוצר בעיקר כתוצאה מקרינה מיננת אך יכול אף להווצר לאחר קרינת UV.
הקרינה המיננת מאופיינת ע"י יכולתה להשרות יצירת יונים חיוביים ושליליים. פעילותה של הקרינה המיננת היא לכן ישירה על מולקולות המטרה דוגמת שחרור אלקטרונים מאטומים ב-DNA. לקרינה זו גם פעילות בלתי ישירה ע"י יצירת רדיקלים דוגמת רדיקלים הידרוקסיליים המגיבים עם ה-DNA. ספיגה ישירה ויחידה של אנרגיה ב-DNA יכולה להביא לצבר של פגיעות כתוצאה מיצירת רדיקלים בסביבה הקרובה למקום הפגיעה. את רובו של האפקט הממית של הקרינה המיננת ניתן ליחס לשברים הנוצרים ב-DNA ובעיקר לשברים הדו-גדיליים (DSB - souble strand breaks). סוג זה של נזק דורש מנגנוני תיקון מיוחדים ובעוד E. coli (וכמוהו רב האורגניזמים האחרים) מסוגלים לתקן בין שניים לשלושה DSB לכרומוזום יכול הדינוקוקוס לתקן למעלה מ-130! DSB מתוך מאות הפרגמנטים של ה-DNA הנוצרים לאחר קרינה בסדרי גודל של 10,000 Gy ויותר, מסוגל הדינוקוקוס תוך 24-12 שעות לבנות את הכרומוזום מחדש ביעילות מופלאה ללא תמותה או מוטגנזה.
מנגנוני תיקון נזקי DNA של הדינוקוקוס
כיצד יתכן מנגנון תיקון יעיל שכזה?ל-E. coli יש שלושה מנגנונים לתיקון נזקים ב-DNA. האחד, תיקון ע"י חיתוך והסרה של בסיסים פגועים - Excision repair, השני תיקון ע"י רקומבינציה, והשלישי הקרוי SOS error prone repair מסלק דימרים של תימין הנוצרים במזלג השיכפול בשלבי הגידול הלוגריתמי של החיידק. בדינוקוקוס קיימים שני המנגנונים הראשונים בלבד.
תיקון ע"י חיתוך והסרה (Excision repair)
לדינוקוקוס שני מסלולים בלתי תלויים של תיקון ע"י חיתוך והסרה. הראשון קיבל את השם UV Endonuclease α הוא תוצר הגן mtcA ההומולוגי
ל-UvrA של E. coli. מקובל היום לחשוב שחלבון זה - UvrA משתתף במסלול תיקון אנלוגי למערכת האנזימים UvrABC של E. coli.
מערכת זו השייכת לאנזימי ה-SOS עוברת אינדוקציה כתוצאה מקרינת UV (כנראה ע"י ה-ssDNA) ומסירה את הבסיסים הפגומים שנוצרו לקראת
תיקונם. בדומה, ה-UV Endonuclease α של הדינוקוקוס חיוני לחיתוך ה-DNA לאחר חשיפה ל-MMC.תאים שבהם מוטציה יחידה באתר זה הופכים רגישים ל-MMC. בניגוד למצב ב-E. coli למוטנטים אלה יציבות לקרינת UV כמו לגזע הבר והם מסוגלים לסלק דימרים של תימין בעזרת אנזים שני, ה-UV Endonuclease β - שהוא תוצר הגן uvsCDE. רק מוטנטים של דינוקוקוס החסרים את שני האנזימים α ו-β יהפכו רגישים ל-UV. האנזים α בודד ונמצא שהוא חלבון מונומרי בגדל 36 kDa המבצע בנוכחות יוני Mn2+ חיתוך אנדונוקלאוליטי סמוך לדימרים של פירימידינים. בשנים האחרונות נמצאו בדינוקוקוס אנזימים נוספים המשתתפים בתיקון נזקי DNA, ביניהם: Thymine - glycol glycosidase, Apurinic/apyrimidinic endonuclease, Uracil DNA Glycosidase ושני אנזימים עליהם נרחיב את הדיבור בהמשך - DNA Polymerase I ו-RecA.
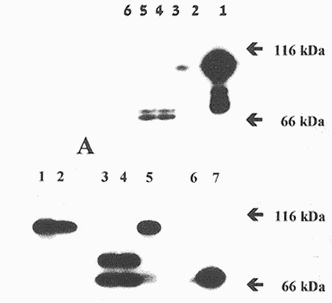
איור 3: בדיקת פעילות DNA פולימרז על גלים של אקריל-אמיד. |
 |
Moseley ו-Copeland הראו שהרגישות של מוטנטים ב-mtcA ל-MMC אינה עולה באם הם פגועים באתר נוסף אותו כינו uvsA. כיום ברור מסדרה ארוכה של מחקרים מקבוצתו של Minton שאותו אתר הוא למעשה אתר ה-pol (המקודד לאנזים DNA polymerase). מכיוון שנוכחות מוטציה ב-pol אינה מעלה, כאמור לעיל, את רגישות החיידקים ל-MMC מעבר למה שמקנה המוטציה ב-mtcA (במוטנט הכפול mtcA pol) יש להניח שה-DNA פולימרז פועל באותו מסלול של ה-UV Endonuclease α. בדומה, היות והמוטנט הכפול הנ"ל רגיש גם לקרינת UV (למרות שהאנזים UV Endonuclease β אינו פגוע) יש להניח שהגורם לרגישות הוא החסר באנזים DNA פולימרז החיוני גם במסלול האנזים β, אחרת למוטנט הכפול הנ"ל הייתה יציבות לקרינת UV כמו לגזע הבר או כמו למוטנט היחיד mtcA.
הזן אותו כינו Moseley ו-Copeland eIvsA הוא הזן 303 (ראה איור 1) שהתקבל ע"י מוטגנזה של גזע הבר (R1) עם ניטרוזוגואנידין. הדינוקוקוס הוא חיידק העובר טרנספורמציה באופן טבעי, כלומר הוא מסוגל לקלוט DNA ממצע הגידול, ואם ההומולוגיה מספיקה - לעשות לו רקומבינציה עם הכרומוזום הבקטריאלי. Minton וחבריו ניצלו תכונה זו ובנו ספריה של קוסמידים המכילה DNA גנומי של גזע הבר. בעזרת ספריה זו נעשתה טרנספורמציה של המוטנט 303 ובודד ה-DNA שהחזיר למוטנט את הפנוטיפ היציב לקרינה ול-MMC של גזע הבר. DNA זה היה ORF בגודל של 2763 בסיסים (921 ח' אמינו) בעל הומולוגיה של 51% ל-DNA המקודד לאנזים DNA polymerase I של E. coli (שלו אורך של 2784 בסיסים ו-928 ח' אמינו). ההומולוגיה והזהות בח' האמינו היו של 53% ו-41% בהתאמה.
זן 303 וזנים מוטנטיים דומים התקבלו ע"י מוטגנזה כימית ואין להוציא מכלל אפשרות שהם פגועים גם בגנים אחרים. כדי להוכיח שפגיעה בגן המקודד ל-DNA פולימרז יכולה לכשעצמה להביא לשינוי הדרסטי של הפנוטיפ, מיציבות קיצונית לנזקי DNA לרגישות הדומה לזו של חיידקים אחרים, החליטו Minton וחבריו להשרות מוטציה מכוונת באתר הפולימרז בשיטות של הנדסה גנטית. זאת עשו ע"י החדרה מכוונת (ע"י טרנספורמציה ורקומבינציה) של מקטע DNA בגדל של 3.1 kb המקנה יציבות לכלורמפניקול לתוך הגן של הפולימרז. הזן שהתקבל, 6R1A, היה איזוגני עם גזע הבר אך פגוע ספציפית באתר pol. מוטנט זה היה רגיש לקרינה מיננת, קרינת UV ו-MMC אף יותר מהזן 303 (איור 1).
בדיקת הפעילות האנזימטית של מיצוי חיידקים על "גל פעילות של אקריל אמיד" (activity gel) הראתה שבדומה לזן 303 (איור 3B) גם זן 6R1 חסר לחלוטין פעילות של DNA פולימרז I (איור 3A). ברור לכן שהאנזים חיוני להקניית היציבות הגבוהה לנזקי DNA. אולם השאלה הנשאלת היא האם הוא מהווה את המפתח ליציבות, כלומר האם לאנזים של הדינוקוקוס תכונות המייחדות אותו מאנזימים דומים בחיידקים אחרים?
כדי לענות על שאלה זו ביטאו Minton וחבריו את הגן DNA polymerase I של E. coli ומקטע ה-DNA המקודד לפרגמנט Klenow של האנזים במוטנטים של הדינוקוקוס. זאת עשו ע"י ניצול תכונה נוספת של הדינוקוקוס - יכולתו לעשות Duplication insertion לגן זר. ע"י שימוש בוקטור אינטגרציה מתאים ניתן להכניס לכרומוזום החיידק גן ללא פרומוטור. הוקטור מכיל מקטע ליציבות לאנטיביוטיקה המבוטאת באופן חלש ביותר. בהשפעת לחץ סלקטיבי של אותה האנטיביוטיקה עובר הוקטור בכרומוזום אמפליפיקציה ומאפשר עי"כ לגן המצורף (ובמקרה זה הפולימרז של E. coli או פרגמנט Klenow שלו) להתבטא במספר רב של עותקים (עד ל-50 לכרומוזום). טרנספורמציה זו עם האנזים של E. coli החזירה למוטנטים את הפעילות האנזימטית (איור 3B) ויחד איתה את הפנוטיפ של זן הבר - היציבות הייחודית לנזקי DNA (איור 1). המסקנה כמובן היא שאין לדינוקוקוס פולימרז בעל יחוד. האנזים (בין אם הוא אנזים עצמי של הדינוקוקוס או אנזים מחיידק אחר) דרוש לחיידק לצורך מנגנוני התיקון היעילים אולם לכשעצמו אין הוא מספיק להקניית העמידות.
תיקון ע"י רקומבינציה
בין שאר המוטנטים שהשרו Moseley ו-Copeland היה זן שכונה rec30 שהיה רגיש ביותר לכל סוגי נזקי DNA. החיידק לקה בכושרו לעבור טרנספורמציה
וגידולו היה איטי. קבוצת המחקר של Minton פיתחה שיטה לטרנספורמציה טבעית של זן זה. למרות שיעילות טרנספורמציה זו הייתה בשני סדרי
גודל קטנה יותר מגזע הבר הצליחו החוקרים, בשימוש במתודולוגיה שהופעלה לגבי ה-DNA פולימרז, לשבט את האתר הפגום שבמוטנט. נמצא שאתר זה
הומולוגי ל-recA של חיידקים אחרים (56% זהות בח' האמינו עם האנזים של E. coli). גם כאן הכינו החוקרים מוטנט בעל מוטציה מכוונת
באתר ולמוטציה זו שכונתה 1R1A היה פנוטיפ זהה למוטנט rec30 - דהיינו רגישות לנזקי DNA. החוקרים הקדישו מאמצים רבים בניסיונות לשבט את
האנזים ב-E. coli ועי"כ לנסות ולשנות את עמידות ה-E. coli לקרינה אולם ללא הצלחה. התאים, במידה והטרנספורמציה הייתה
מוצלחת, עברו ליזיס. הסיבה, לדעתם של החוקרים, יכולה להיות מכיוון שב-E. coli חלק גדול מה-RecA קשור לממברנה והכנסת האנזים
הדינוקוקלי יכולה לגרום לשיבושים בקשר זה ולנזק בממברנה, או שהאנזים של הדינוקוקוס גורם לאינטרקציה של DNA-DNA באתרי הקישור של ה-DNA
לממברנה ועי"כ גורם לנזק ממברנלי ולליזיס.בדומה למה שנעשה לגבי ה-DNA פולימרז ניסו Minton וחברי קבוצת המחקר שלו להחדיר recA של חיידק זר לדינוקוקוס. הפעם השתמשו מסיבות טכניות בגן של Shigella flexneri שהאנזים לו הוא מקודד זהה לזה של E. coli. למרות ביטוי חזק של הגן בדינוקוקוס (שהוכח ע"י Western blot) לא היה כל שינוי בפנוטיפ של המוטנטים rec30 ו-1R1A הם נשארו רגישים לקרינה, בעלי יכולת טרנספורמציה טבעית נמוכה וגידול איטי. כלומר, למרות שקומפלימנטציה טבעית של recA בין זני חיידקים שונים היא תופעה רווחת הרי שהדינוקוקוס הוא היוצא מן הכלל ודורש, אולי, אנזים בעל תכונות מיוחדות.
recA בדינוקוקוס מתבטא רק לאחר החשיפה לקרינה - mRNA של החלבון לא ניתן לזיהוי לפני החשיפה, מיד לאחריה ו-24 ו-48 שעות אחריה. רק בין 9-1.5 שעות לאחר הקרנת החיידק ב-Gy 17,000 (D37) ניתן היה לזהות mRNA לחלבון. יתכן והסיבה היא ש-Rec30 בתאי דינוקוקוס שלא ניזוקו מעכב גידול בגלל האינטרקציה שלו עם ה-DNA ולכן נמנע ביטוי החלבון בתאים לא פגועים.
מהי פעולתו של אנזים זה? בתאים פרוקריוטים מחפש האנזים אזורים הומולוגיים בין שתי מולקולות של DNA דו-גדילי, מביא לחילופי מקטעי גדילים ומעורב בתיקון DSB. כאמור לעיל ב-E. coli כמו ברוב האורגניזמים, מסוגל האנזים לתקן 2-3 DSB מבלי שתגרם תמותה. E. coli חייב להיות recA+ ויש הכרח בנוכחות כרומוזום בקטריאלי נוסף (ל-E. coli 4-5 כרומוזומים בקטריאליים הפלואידים בשלב הגידול הלוגריתמי שלו). יכולת זו רחוקה מכושרו המופלא של הדינוקוקוס לתקן למעלה מ-130 DSB מבלי שתגרם תמותה.
בתאים איקריוטיים שהם באופן טיפוסי דיפלואידיים או טטרפלואידיים הרקומבינציה בין הכרומוזומים היא תכונה נורמלית החלה במיוזה. בשמרים מקובל כיום לחשוב ש-DSB המושרים ע"י השמר עצמו, שמספרם כ-100, הם הפריקורזורים לרקומבינציה שבמיוזה. לחלבון RAD51 בשמרים, שהוא החלבון המקביל ל-recA, פעילות in vitro דומה לאחרון והומולוגיה בחומצות האמיניות.
תהליך הרקומבינציה שבתאים האיקריוטיים יכול לתרום אולי להבנת התהליך החל בדינוקוקוס. בחלוקה המיוטית הראשונה של התאים האיקריוטיים, בשלב הפרופזה, הכרומוזומים ההומולוגיים נצמדים יחדיו ליצירת דופלקס במכניזם שעדיין אינו מובן כל צורכו. ישנה השראה של DSB וחילופי מקטעים מתאימים בין הגדילים. כאמור השמרים מסוגלים לתקן כ-100 DSB כחלק מתהליך החלוקה שלהם, בתנאי שהכרומוזומים מזווגים אחד למשנהו כך שה"סובסטרט" לרקומבינציה זמין מידית ובמקום הדרוש. יתכן ומנגנון דומה קיים בדינוקוקוס. הכרומוזומים הבקטריאליים ההפלואידים של הדינוקוקוס עשויים להיות מוצמדים בהתאמה מלאה אחד למשנהו דבר הנותן יתרון משמעותי בתיקון DSB. הרמה הגבוהה של רקומבינציה בין-כרומוזומלית יכולה לנבוע מהמספר הגבוה של הכרומוזומים בדינוקוקוס. בשלב הגידול הסטציונרי יכול מספרם להיות בין 4 ל-5 והוא עולה לעד 10-8 בשלב הגידול הלוגריתמי. מספר גבוה של כרומוזומים אינו נדיר בין החיידקים ואינו בהכרח קשור ליציבות לנזקי DNA. לדוגמה ל-Micrococcus sodonensis מספר גבוה של כרומוזומים והם רגישים לקרינה. ל-Azotobacter vinelandii קרוב ל-80 כרומוזומים ונמצא שהוא רגיש לקרינת UV. לכן יש להניח שיש גורמים נוספים מלבד מספר רב של כרומוזומים המשתתפים בתיקון נזקי DNA. Minton וחבריו סוברים ששלב חשוב בתיקון הנזק הוא שלב ההצמדה המותאמת של הכרומוזומים. הם מעלים את ההשערה שהצמדה זו נעשית ע"י צמתי Holliday (Holliday Junctions). קשרים אלה הקרויים גם Four strand junctions הם קשרי ביניים בתהליך הרקומבינציה בין אזורים זהים או הומולוגיים של שני דופלקסים של DNA. הקשרים עצמם הם בעלי אופי חד-גדילי ומסוגלים לנוע חופשית באזור הזהות או בצורה ספונטנית או באופן אנזימטי. אם אכן קיים בדינוקוקוס סידור כרומוזומלי כזה ניתן יהיה להסביר את יעילות הרקומבינציה ביתר קלות. ל-Minton וחבריו ממצאים פרלימינריים התומכים בהשערתם כמו צביעה ב-DAPI המגלה צורות טבעתיות שלא הובחנו באורגניזמים אחרים.
סיכום
כ-40 שנה חלפו מאז בודד הדינוקוקוס לראשונה ונלמדו תכונותיו. למרות המאמץ המחקרי הרב שהושקע בברור המנגנונים האחראיים לעמידותו הייחודית
בפני נזקי DNA שונים לא נמצאה עדיין התשובה הברורה לכושרו המדהים של החיידק לתקן נזקים אלה. האם תורמים לכך מבנה הדופן המיוחד שלו,
תכולת המולקולות התוך-תאיות המיוחדת או אנזימי תיקון יחודיים? קשה בינתיים לתת תשובה ברורה. יתכן וכל הגורמים האלה חוברים יחד
וכתוצאה מתקבל מנגנון התיקון היעיל ביותר בטבע. אם תוכח נוכחותם של צמתי Holliday (כפי שמציעים Minton וחבריו) ברור שלהצמדת
הכרומוזומים הרבים של החיידק ליחידה מותאמת אחת השפעה מכרעת בתהליכי תיקון שונים ובעיקר בתהליך הרקומבינציה. בתהליך תיקון זה משתתף
כנראה אנזים ייחודי לדינוקוקוס (שלא כדוגמת ה-DNA פולימרז הפועל באותה מידה של הצלחה גם אם מקורו מחיידקים אחרים).האם לדינוקוקוס מאפינים נוספים היחודיים רק לו, גם על כך קשה עדיין לענות, רק אפס קצהו של גנום החיידק זוהה. קביעת רצף ה-DNA של כל החיידק רק היא שתוביל להבנה משמעותית יותר של הביולוגיה שלו. ואכן, לאחרונה פנה משרד האנרגיה האמריקאי לחברת TlGR (The Institute for Genomic Research) והציע לה חוזה שבמסגרתו יקבע רצף הבסיסים המלא ב-DNA של הדינוקוקוס.
הערה:
עם הבאת הדברים לדפוס הופיעה סקירה קצרה ב-ASM News מחדש אפריל 1996 המציינת עבודה חדשה של Battista ו-Mattinore המתיחסת לעמידות הדינוקוקוס לתנאי יובש ופורסמה ב-J. Bacteriol. 178 (1996), 633.
לקריאה נוספת
- Moseley, B.E.B. (1983) Photochem. Photobiol. Rev. 7, 223.
- Gutman P. and Minton K.W.(1994). Mutation Res. DNA Repair 314, 87.
- Minton K.W (1994). Molec. Microbiol. 13(1), 9.
- Minton K.W (1995). BioEssays 17(5), 457.