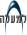
תצלום מיקרוסקופ אלקטרונים סורק של חיידקי
Mycoplasma mycoides שמקורם בתא "ריק" של M. capricolum שאליו הוחדר הכרומוזום הסינתטי.
J. Craig Venter Institute. Provided by Tom Deerinck and Mark Ellisman of the National Center for Microscopy and Imaging
Research
at the University of California at San Diego
החיים (והגנום) הקטנים ביותר
מהו התא הקטן ביותר הקיים? כמה גנים דרושים לקיומו של תא כזה? והאם ניתן ללמוד ממנו על התאים החיים הראשונים? את התשובה האחרונה לשאלות
אלו סיפקו חיידקי המיקופלסמה (Mycoplasma), שהם בין החיידקים החופשיים הקטנים ביותר - גודלם כ-0.3 מיקרומטר.באוגוסט 1995 פרסמה קבוצתו של קרייג ונטר, אז במכון לחקר הגנום, את הרצף המלא של הגנום של החיידק החופשי Mycoplasma genitalium - חיידק החי גם במערכות המין והנשימה של פרימטים שונים, ובהם האדם. אורך הגנום של M. genitalium הוא 580,070 נוקליאוטידים, הכוללים רק 482 גנים המקודדים לחלבונים ו-43 גנים המקודדים למיני ה-RNA השונים. אמנם, ב-2003 פרסמו חוקרים מתאגיד דייוורסה (Diversa) את רצף הגנום של הארכאון Nanoarchaeum equitans, שגודלו כ-0.4 מיקרומטר, ואורך הגנום שלו קטן עוד יותר - 490,885 בסיסים; ובשנת 2006 פרסמה קבוצת חוקרים יפנים (Nakabachi ועמיתיו) את רצף הגנום של החיידק Carsonella ruddii, שלו גנום מינימלי ביותר - 159,662 בסיסים. אך שני אלה אינם יצורים חופשיים, וחלקים מהמטבוליזם שלהם תלויים ביצורים האחרים שעמם הם חיים - N. equitans בארכאונים מהסוג Ignicoccus, ואילו C. ruddii, שהוא אנדוסימביונט הכרחי של כנימות, בכנימות המאכסנות. הגנום של אורגניזמים אלה אינו מהווה, אפוא, גנום של תא עצמאי.
השוואה שנעשתה ב-1996 בין שני הגנומים הראשונים שרוצפו לגמרי - של M. genitalium (מחטיבת הפירמיקוטים) ושל Haemophilus influenzae (מחטיבת הפרוטאובקטריה), שהם שני חיידקים רחוקים למדי זה מזה מבחינה אבולוציונית - העלתה 256 גנים משותפים. לפיכך שיערו ארקדי מושגיאן (Mushegian) ויוג'ין קונין (Koonin), שזהו הרכב הגנים המינימלי ההכרחי לקיומו של תא חי. ב-2004 חישבו רוזריו גיל (Gil) ועמיתיו מאוניברסיטת ולנסיה, על פי השוואות בין גנומים מפוענחים רבים של חיידקים, את מספר הגנים ההכרחיים לתא, והגיעו לערך של 206 גנים.
קבוצתו של ונטר החליטה לבדוק כמה מאותם 482 גנים מקודדי חלבונים של M. genitalium (ומקביליהם בחיידק הקרוב אליו M. pneumoniae) אכן הכרחיים לתפקוד התא החיידקי. כדי לבדוק זאת הושרו בעזרת טרנספוזונים מוטציות בגנים מסוימים, ובסופו של דבר נמצאו כ-100 גנים שאינם חיוניים לקיומו של החיידק - לפחות בתנאי מעבדה. תא החיידק המוטנטי שהתקבל חי ומתפקד כשבגנום שלו רק 387 גנים מקודדי חלבונים ו-43 גנים מקודדי RNA. מעניין לציין, שעדיין לא ידוע מהו תפקודם בתא של כרבע מאותם גנים חיוניים.
 |
ונטר: האיש, הגנום, המכון
קרייג ונטר, הוביל את סלרה גנומיקס במיפוי הגנום האנושי - בין השאר, ה-DNA שלו עצמו |
ונטר ייסד ב-1992 את המכון לחקר הגנום (The Institute for Genomic Research, TIGR), ובמסגרתו היה הראשון לפרסם, בשנת 1995, רצף מלא של גנום של יצור חי, החיידק Haemophilus influenzae. מאז פרסם המכון את רצפיהם של מאות גנומים נוספים.
ב-1998 ייסד ונטר את חברת סלרה ג'נומיקס, שב-2001 השלימה את קביעת רצף הגנום האנושי, בתקציב נמוך יותר, בשיטות אחרות (shotgun sequencing) ובזמן קצר יותר מפרויקט הגנום ה"ממלכתי". הגנום שריצפה החברה היה תערובת של חמישה תורמים מגזעים שונים, וביניהם גם ונטר עצמו. בהמשך ריצפה החברה גם את הגנומים המלאים של זבוב הפירות, עכבר הבית והחולדה. ב-2002 חדל קרייג ונטר לשמש כנשיא החברה, ובהמשך עזב אותה.
בשנת 2006 איחד ונטר את חמש החברות האחרות שהיה מעורב בהן - המכון לחקר הגנום, המרכז לקידום הגנומיקה (The Center for the Advancement of Genomics, TCAG), קרן ונטר למדע (The J. Craig Venter Science Foundation), המרכז לטכנולוגיה מאוחדת (The Joint Technology Center) והמכון לאנרגיה ביולוגית חלופית (The Institute for Biological Energy Alternatives, IBEA) - במסגרת מכון קרייג ונטר (J. Craig Venter Institute, JCVI). במכון, שפעילותו נחלקת בין רוקוויל, מרילנד, לסן דייגו, קליפורניה, מועסקים כ-400 חוקרים, העוסקים בגנומיקה חיידקית, צמחית, סביבתית וכמובן, גם בגנומיקה של האדם.
שעטנז גנטי
כרומוזום הנמצא בתא מסוים אינו פועל בריק. הוא מוקף במערכות האנזימיות של התא, שהמידע ליצירתן הגיע מהכרומוזום-ההורה שממנו נוצר
הכרומוזום הנוכחי. ידוע לנו שכאשר חודר לתוך תא חיידק מקטע DNA זר (בטרנספורמציה, בקוניוגציה או בטרנסדוקציה) - אם הצליח לעמוד
בפני מערכות ההגנה של התא (אנזימי הרסטריקציה), הגנים שבו באים לידי ביטוי בתא. האם הדבר נכון גם למסה גדולה של DNA? האם גם גנום זר, בחלקו או בשלמותו, יתבטא במאכסן? ניסוי ראשוני שנועד לתת מענה לשאלה זו ערכו ב-2005 מיצוהירו איטיה (Itaya) ועמיתיו. החוקרים החדירו לתא של Bacillus subtilis, בטרנספורמציה, גנום כמעט שלם של החיידק הכחולי Synechocystis PCC6803. בתא המקבל התחוללה רקומבינציה, ונוצר כרומוזום כימרי שהכיל הן את הגנום של התורם והן את הגנום של המקבל. אך מרבית הגנום של החיידק הכחולי לא התבטא כלל בתא המקבל, כנראה בשל נוכחות הכרומוזום המקורי של B. subtilis, והפנוטיפ של החיידק הכימרי היה כשל החיידק המקבל.
בניסוי דומה שערכו, ב-2007, רוברט הולט (Holt) ועמיתיו מהמרכז למדעי הגנום על שם מיכאל סמית בקנדה, החדירו החוקרים כרומוזום של Haemophilus influenzae לתא של Escherichia coli. גם ניסוי זה נכשל, ומרבית הכרומוזום המוחדר לא התבטא בתא המקבל. האם להיעדר הביטוי אחראי המרחק האבולוציוני הגדול יחסית בין שני מיני החיידקים? או שמא סיבות אחרות, כגון חוסר התאמה בין הגנום המוחדר לאנזימים של התא המקבל - שאינם "מבטאים" אותו?
גנום חדש, זהות חדשה
הצעד המתבקש הבא היה הפרדה בין שני מרכיבי התא העיקריים: החומר התורשתי וגוף התא. האם ניתן לחבר בין תא לבין חומר תורשתי ממקורות
שונים? כאן מדובר, למעשה, בהשתלת גנום, שכן הגנום של החיידק המאכסן מסולק ממנו. קבוצתו של קרייג ונטר ערכה ניסוי זה בשנת 2007.
הניסוי נערך בשני מינים שונים מן הסוג Mycoplasma, הקלים יותר לגידול במעבדה ובעלי זמני דור קצרים יותר
מ-M. genitalium: החיידק תורם ה-DNA היה M. mycoides (המוכר בעיקר לווטרינרים ולרפתנים, כגורם לדלקת
מידבקת של ריאות וקרומים בפרות - Contagious bovine pleuropneumonia), והחיידק המקבל היה M. capricolum
(המוכר בעיקר כגורם לדלקות ריאות בעיזים, אך גם בחיות משק אחרות). שני המינים הם בעלי גנום קטן יחסית וזמן דור של 80 ו-100
דקות בהתאמה. התורם היה עמיד לטטרציקלין, ואילו המקבל היה רגיש לאנטיביוטיקה זו.הרצף המלא של הגנומים של שני החיידקים היה ידוע. כמו כן היה ידוע שפלסמידים שמקורם ב-M. mycoides יכולים להתרבות ב-M. capricolum, אך לא להפך. בין רצפי ה-DNA של שני החיידקים יש חפיפה של כ-76%, שבאזורים מסוימים מגיעה אף ל-91.5%.
הכרומוזום של החיידק M. mycoides הופרד מהתא התורם ואחר-כך גם מכל החלבונים הקשורים אליו. תאי החיידק המקבל, שאינם עמידים לטטרציקלין, גודלו במצע מינימלי ללא נוקליאוטידים. בתנאי גידול אלה מתקבלים פיצולי תאים, חלקם ללא DNA. תערובת התאים הודגרה בתנאים המתאימים עם ה-DNA של התורם ואחר-כך נזרעה על צלחות עם מצע גידול הכולל טטרציקלין. מצע גידול זה אינו מאפשר גידול של תאי המקבל אלא אם קלטו כרומוזום של התורם. הניסוי כלל שתי קבוצות ביקורת: של תאי החיידק המקבל ללא DNA של התורם, ושל DNA של התורם ללא תאי החיידק המקבל. קבוצות אלו עברו את כל התהליך במקביל לקבוצת הניסוי.
בשתי קבוצות הביקורת לא גדלו כל חיידקים על צלחות מצע הגידול. בקבוצת הניסוי גדלו מושבות חיידקים. מושבות אלו נבדקו, ונמצא כי החיידקים שבהן אכן מכילים רק את הגנום של התא התורם ולא את הגנום של התא המקבל. בדיקה זו נעשתה כדי לשלול אפשרות שהתא המקבל קלט רק קטעי DNA מסוימים ורלוונטיים מגנום התורם. הבדיקה נעשתה על ידי בדיקות PCR של רצפים האופייניים לשני מיני החיידקים.
הפנוטיפ של החיידקים המושתלים - וצאצאיהם - נבדק על ידי נוגדנים מתאימים ואנליזה של חלבונים בשיטות שונות, ונמצא כי אינו שונה מהפנוטיפ של תאי החיידק התורם, M. mycoides.
ראוי לציין שניסוי זה נעשה בשני מינים קרובים מאוד של חיידקים - מאותו סוג - ואף על פי כן, יעילות התהליך הייתה נמוכה מאוד (1:150,000). שאלה מעניינת היא, אם יצליחו לחזור על הניסוי הזה בחיידקים מחטיבות שונות - שם היעילות צפויה להיות נמוכה הרבה יותר.
כרומוזום מעשי ידי אדם (ושמר)
בשלב הבא, בניסוי שממצאיו התפרסמו ביולי 2010 במגזין Science, החליף את הכרומוזום הטבעי המושתל כרומוזום סינתטי לחלוטין. ונטר
ועמיתיו סנתזו, מנוקליאוטידים יחידים, כרומוזום סינתטי - על פי רצף הנוקליאוטידים של זן מסוים של M. mycoides (שפוענח
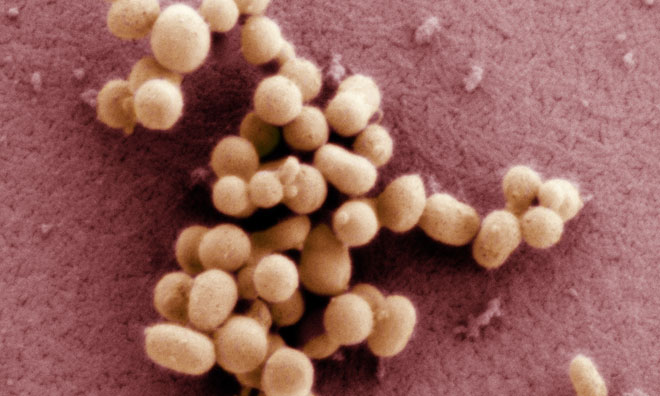
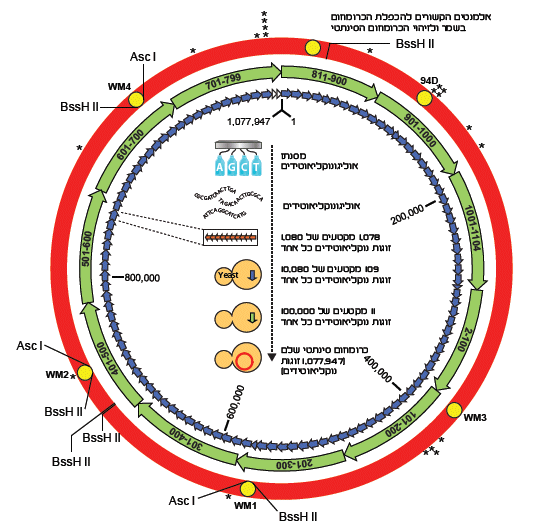
ופורסם). אורך הכרומוזום הסינתטי, שהוספו לו גם רצפים מיוחדים שאפשרו להבחין בינו לבין גנום "מקורי" של החיידק, היה 1,077,947
נוקליאוטידים.סינתזת מולקולת DNA בהיקף של מיליון נוקליאוטידים אינה משימה קלה לביצוע, והיא התבצעה בשלבים (ראו איור).
תרשים של תהליך בניית הכרומוזום הסינתטי. J. Craig Venter Institute.
כמו בניסוי הקודם, התא המקבל החל לתפקד ולהתרבות בהתאם למידע המקודד בגנום המושתל, במקרה זה - גנום סינתטי. מבחינה פנוטיפית, היו אלה תאי M. mycoides לכל דבר.
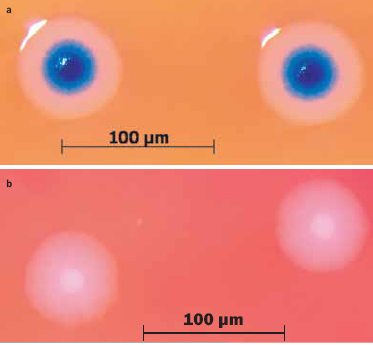
השוואה בין תאים יחידים (למטה) ומושבות (למעלה) של
M. mycoides שמקורו בגנום הסינתטי (משמאל) ושל חיידק הבר (מימין). J. Craig Venter Institute.
ההשתלה המוצלחת של הגנום הסינתטי עשויה להוות ניצן של ענף ביולוגי שכבר זכה לשם גנומיקה סינתטית (synthetic genomics), שבמסגרתו יהונדסו גנומים שלמים של מיקרואורגניזמים שונים תוך שימוש בגנים (מקוריים או סינתטיים) של יצורים אחרים - לאו דווקא מיקרואורגניזמים - בהתאם לצרכים שונים: רפואיים, תעשייתיים וסביבתיים, קיימים ועתידיים. ולאחר שיצטבר די ידע וניסיון, ייתכן שיהונדסו כך גם תאים של יצורים מורכבים יותר...
סיכום
גם הגנום הקטן ביותר עדיין צופן סודות רבים, שעלינו לפענחם כדי להתקרב להבנה של מהות החיים. החלפת כרומוזום טבעי בכרומוזום זר
או בכרומוזום סינתטי היא הישג טכנולוגי חשוב, שאמנם אינו מקרב אותנו אל חיים מלאכותיים, אך הוא פותח בפנינו עידן חדש של גנומיקה
סינתטית. בהמשך ייערכו בוודאי ניסויים נוספים, שיקרבו אותנו ולו גם במקצת אל סודות התא הראשוני.לקריאה נוספת:
- CM Fraser, JD Gocayne, O White, MD Adams, RA Clayton, RD Fleischmann, CJ Bult, AR Kerlavage, G Sutton, JM Kelley,
JL Fritchman, JF Weidman, KV Small, M Sandusky, J Fuhrmann, D Nguyen, TR Utterback, DM Saudek, CA Phillips, JM. Merrick,
J-F Tomb, BA Dougherty, KF Bott, P-C Hu, TS Lucier, SN Peterson, HO Smith, CA Hutchison III, JC Venter, 1995, The Minimal Gene Complement of
Mycoplasma genitalium, Science Vol. 270. no. 5235, pp. 397-404
- JI Glass, N Assad-Garcia, N Alperovich, S Yooseph, MR Lewis, M Maruf, CA Hutchison III, HO. Smith, and JC Venter, 2006,
Essential genes of a minimal bacterium, PNAS vol.
103 pp. 425-430.
- AR Mushegian & EV Koonin, 1996, A minimal gene set for cellular life derived by comparison of complete bacterial genomes,
Proc. Natl. Acad. Sci. USA Vol. 93, pp. 10268-10273.
- R Gil, FJ Silva, J Peret?, & A Moya, 2004, Determination of the Core of a Minimal Bacterial Gene Set, Microbiology and Molecular Biology
Reviews 68, pp. 518-537.
- DG Gibson, JI. Glass, C Lartigue, VN Noskov, R-Y Chuang, MA Algire, GA Benders, MG Montague, L Ma, MM Moodie, C. Merryman,
S Vashee, R Krishnakumar, N Assad-Garcia, C Andrews-Pfannkoch, EA Denisova, L Young, Z-Q Qi, TH Segall-Shapiro, CH Calvey,
PP Parmar, CA Hutchison, III, HO Smith, JC Venter, 2010, Creation of a Bacterial Cell Controlled
by a Chemically Synthesized Genome, Science. 329. no. 5987, pp. 52-56.
באדיבות מערכת Bioinform