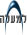אף כי על פניו נראה כי גופנו וגופם של כל היצורים החיים - צמחים ובעלי חיים כאחד, יציב ושומר על צורה ומשקל קבועים פחות-או-יותר, לפחות בטווח זמן של ימים וחודשים, למעשה אין הדבר כך. מרכיביו הכימיים של הגוף נמצאים במצב תחלופה קבועה, יצירה ופירוק, תהליך המתרחש ללא הרף ובמהירות רבה. יש מרכיבים בגוף המתחלפים מדי מספר דקות, אחרים כל כמה שעות ויש המתחלפים אחת למספר ימים. תהליך התחלופה חשוב מאין כמוהו, ואנו נתרכז כאן בתהליך תחלופת החלבונים, מן המרכזיים שבמרכיבי הגוף החי. נשאלת השאלה: למה אדם, מגיל הבגרות ועד יום מותו, לא נשאר עם אותן מולקולות חלבונים בגופו? מדוע מתחלפים החלבונים בגוף ללא הרף?
מות החלבונים ככורח חיים
אלפי חלבונים שונים מצויים בכל תא, והם ממלאים תפקידי מפתח. והנה, למרות שחלבונים נחשבים לאבני הבניין של התא, אין הם יציבים כפי שניתן היה לצפות. לכל אחד מן החלבונים בתא תוחלת חיים משלו, מספר שעות או אף דקות אחדות בלבד. תחלופת החלבונים בגוף היא צורך חיוני ממדרגה ראשונה. חלבונים פגומים נוצרים בגוף ללא הרף. קרינת השמש ובעיקר הקרינה העל-סגולה, זיהום האוויר ומרכיבים שונים במזון - כל אלה עלולים לפגוע בחומר הגנטי של התאים ולגרום למוטציות המביאות ליצירת חלבונים פגומים. פגיעה בחלבונים עלולה לגרום להפרעה בתפקודם ולעתים אף להוציא את התא מכלל פעולה. חייבת, אם כך, להיות בתא, מערכת המסוגלת לזהות את החלבונים הפגומים ולסלקם ביעילות.
יש מצבים נוספים המחייבים פירוק חלבונים. למשל, במצב של רעב לאחר שהגוף ניצל את כל מלאי הסוכר הזמין, או במחלת הסוכרת, כשהסוכר אינו זמין לתאים בגלל מחסור באינסולין. במצבים כאלה הגוף נאלץ לפרק חלבונים כדי לספק לעצמו את האנרגיה הדרושה. פירוק חלבונים נדרש גם בכדי לאפשר התרחשות תהליכים חיוניים. למשל, בתהליכי התמיינות תאים הקורים בשלבים שונים של התפתחות העובר, תאים על חלבוניהם מושמדים כתנאי להיווצרות איברים מסוימים. ישנם מצבים שברגע מסוים יש צורך בסילוק חלבונים מסוימים, למשל, סילוק של חלבונים המעכבים חלוקות תאים. תאי גוף רבים מתחלקים מעת לעת באורח קבוע - תאי העור, התאים היוצרים שערות, התאים המרפדים את צינור העיכול, ותאי מח העצם. אך לא כל התאים מתחלקים בקצב שווה. תאי מערכת העיכול, למשל, מתחלקים אחת ליומיים, תאי דם לבנים חיים בממוצע יומיים-שלושה, ותאי העור מתחלקים אחת לחמישה עד שבעה ימים. לעומתם יש תאים, כמו תאי השריר ותאי המוח במבוגר, שאינם מתחלקים כלל. בכדי שתהליך החלוקה יצא לפועל בזמן ובמקום הנכונים, יש צורך בסילוק חלבונים מיוחדים מעכבי חלוקה הקרויים ציקלינים, וזאת בנקודת זמן מדויקת ומתוזמנת עם תהליך החלוקה של כל קבוצת תאים.
חלבונים אחרים הנועדים לפירוק הם אותם חלבונים המשמשים מתגי הפעלה של הגנים - כשהם "כבויים", הגנים אינם באים לידי ביטוי, וכשהם "דלוקים", מתבטאים הגנים. גורמים אלה פועלים על הגנים בתהליך השעתוק מדנ"א לחלבון, ולכן הם נקראים "גורמי שעתוק". אלה הם חלבונים האחראים על הביטוי הייחודי של חלק מרפרטואר ה-דנ"א בתאים, כך שכל רקמה תבטא רק את החלבונים הדרושים לתפקודה. למרות שכל תאי הגוף מכילים את מלוא המידע הגנטי, רובו אינו בא לידי ביטוי בכל תא ותא. הכבד, למשל, מבטא רק את החלבונים הדרושים לתפקודו, רקמת המוח - את אלו הדרושים לתפקודה, וכך שאר רקמות הגוף. מתגי ההפעלה הם המקנים לתאים השונים את אופיים הייחודי בהתאם לגנים שאותם הם מפעילים. גם מתגי ההפעלה מצטברים או מתפרקים בעקבות אותות סגוליים (ספציפיים). חלק מרקמות הגוף מבטאות מידע ייחודי רק בהתעורר צורך לכך. למשל, מערכת החיסון מפעילה נוגדנים או גורמים אחרים המסייעים לה במלחמתה בפולשים זרים (חיידקים, נגיפים), רק כאשר אלה פולשים לגוף. הפעלה זו דורשת שפעול או הרס של החלבונים המשמשים מתגי הפעלה של הגנים הקשורים במערכת החיסון.
אחד המנגנונים החשובים בגוף להגנה מפני סרטן מורכב מקבוצה של חלבונים הקרויים "דכאני סרטן". חלבונים אלה מוציאים להורג את התא הסרטני. במקרה והנזק שנגרם לתא ניתן לתיקון, הם עוצרים את חלוקתו עד להשלמת התיקון. תהליכים אלה דורשים זירוז או עיכוב בררני של מערכת פירוק החלבונים: כאשר נוצר נזק, עולה רמתו של החלבון מדכא הסרטן ופירוקו מתעכב, וכך הוא יכול לתפקד ולסייע בתיקון הנזק. עם תיקון הנזק בתא פירוקו של החלבון מזורז ורמתו בתא יורדת במהירות.
אנזימים המשתתפים בתהליכים חיוניים בתא גם הם חייבים לעבור פירוק מיידי ברגע מסוים ובכך לווסת את הנתיב לו הם אחראים. כך למשל האנזים אורניתין-דקרבוקסילז, ODC, המעורב ביצירה של חומצות גרעין. רמתו מווסתת את קצב יצירת ה-דנ"א בתא: כאשר מתעורר צורך בסינתזת דנ"א, רמת האנזים עולה, וכאשר הוא מסיים את תפקידו הוא מתפרק במהירות. היכולת המופלאה לייצר בתנאים מסוימים אנזימים או חלבונים שונים, וברגע מסוים לפרקם, היא המאפשרת לגופנו להסתגל למצבים משתנים.
חלבון קטן חורץ גורלות
פירוק החלבונים הוא תהליך סגולי ובררני. החלבונים המיועדים לסילוק נבחרים בקפידה ועוברים תהליך פירוק זהיר ומתואר היטב עם שאר פעילויות התא. מיהו המוציא להורג הנאור שיודע להבחין בתא בין חלבון שדינו להתפרק בזמן מסוים ובין חלבון שמועמד להתפרק בזמן אחר, ולהבדיל ביניהם ובין חלבון שאינו נידון למות? מערכת כזו, המבצעת "הוצאה להורג" של חלבוני התא, התגלתה לראשונה לפני כעשרים שנה על-ידי אברהם הרשקו ותלמידו דאז, אהרון צ'חנובר, מהפקולטה לרפואה של הטכניון בחיפה. הרשקו וצ'חנובר גילו חלבון קטן בשם אוביקוויטין (Ubiquitin), הממלא את התפקיד המרכזי בתהליך חיסול החלבונים - זהו "סמן המוות" של החלבונים ש"גורלם נחרץ". זוהי מערכת פירוק יעילה ומדויקת ובה משתתפים אנזימים רבים המתואמים בפעולתם ומתוזמנים היטב. אנזימי המערכת מסמנים את החלבון הנידון למוות בכך שהם מדביקים אליו את מולקולת האוביקוויטין. לאחר הדבקת "סמן המוות" מפורק החלבון המוצמד לאוביקוויטין על ידי אנזים המזהה רק חלבונים אליהם מוצמד "סמן המוות". הצמדת האוביקוויטין לחלבון מתרחשת בתהליך תלת-שלבי (ראו איור): תחילה מתרחש שפעול של אוביקוויטין על ידי "האנזים משפעל האוביקוויטין", ששמו E1. אנזים זה מייצר, יחד עם מולקולת האוביקוויטין, תוצר ביניים עתיר אנרגיה. לאחר השפעול, נכנס אנזים נוסף לתמונה - "אנזים-מצמד-האוביקוויטין", E2 - המעביר מולקולת אוביקוויטין מ-E1 לאנזים שלישי, E3. E3 מחבר את האוביקוויטין לחלבון המיועד לפירוק.
מהו המנגנון הקובע את הסגוליות והבררנות של המערכת? מדוע חלבונים מסוימים יציבים מאוד בעוד שאחרים הם קצרי חיים? מדוע חלבונים מסוימים מתפרקים בנקודת זמן מסוימת במהלך מחזור התא ואחרים רק בעקבות גירוי חוץ-תאי ייחודי? לא על כל השאלות נמצא עד היום מענה. החלבונים מוכרים על ידי אנזימי ה-E3 השונים - חלקם מוכרים באמצעות אותות ראשוניים, למשל זהותה של חומצת האמינו הממוקמת בקצה החלבון, ומשמשת סימן לקשירה ישירה של החלבון ל-E3. חלבונים רבים אחרים חייבים לעבור שינוי אחר, למשל, להתקשר לקבוצות זרחניות, או להתחבר לחלבונים אחרים (חלבוני עזר) הדואגים לשמור את החלבון המיועד לפירוק במבנה המאפשר את היכרותו על ידי האנזים המתאים.
בתהליך הצימוד נצמדת, כאמור, מולקולת אוביקוויטין לחלבון היעד. מיד לאחר מכן נצמדת מולקולת אוביקוויטין שנייה לקודמתה, והתהליך נמשך עד שנוצרת שרשרת רבת-אוביקוויטין הקשורה לחלבון היעד דרך מולקולת האוביקוויטין הראשונה. שרשרת זו היא "סמן המוות" המסמן ל"אנזימי החיסול" להתחיל במלאכה. תהליך החיסול מתבצע באמצעות אנזים ענק הנקרא פרוטאזום, ש"מומחיותו" בפירוק תצמידי אוביקוויטין. תוך כדי התהליך משתחררות מולקולות האוביקוויטין והן נכנסות למאגר התאי לשימוש חוזר. פענוח המבנה הגבישי של הפרוטאזום בשמרים הביא לפריצת דרך בהבנת מנגנון פעולתו של אנזים ענק זה. הוא בנוי ממספר רב של תת-יחידות המקנות לו מבנה דמוי גליל שבליבתו נמצא החלק המפרק ומשני קצותיו נמצאות תת-יחידות הבקרה, האחראיות להכרת השרשרת רבת-האוביקוויטין. כיצד נכנס החלבון המיועד לחיסול אל תוך המבנה הגלילי וכיצד יוצאים משם תוצרי הפירוק? על כך אין עדיין תשובה ברורה, אך חוקרים מניחים כי בתוך גליל הפרוטאזום מתרחשת תזוזה של תת- היחידות וכך נוצרים פתחים המובילים לאתרי הפירוק.
בסופו של התהליך משתחררות, כאמור, מולקולות האוביקוויטין למאגר התאי. שלב זה חשוב למחזור מולקולות האוביקוויטין וסימון חלבונים נוספים המיועדים לפירוק, וכן לתיקון ולהסרת שרשרות אלו מחלבונים שסומנו בטעות ואינם מיועדים להשמדה.
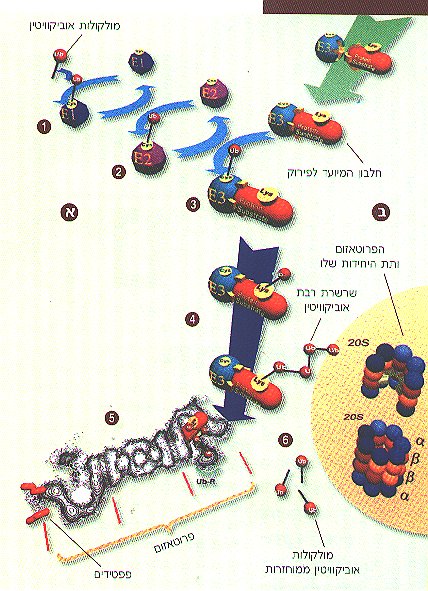
מערכת הפירוק תלויית האוביקוויטין: (א) צימוד האוביקוויטין לחלבון המטרה. (ב) פירוק החלבון המצומד על ידי הפרוטאזום. (1) שפעול אוביקוויטין על-ידי E1 (2) העברת אוביקוויטין משופעל מ-E1 ל-E2. (3) העברת אוביקוויטין משופעל מ-E2 ל-E3 סגולי לחלבון המיועד לפירוק. (4) היווצרות המכלול חלבון-E3 ויצירת שרשרת רבת-אוביקוויטין. (5) קשירת התצמיד אוביקוויטין-חלבון לפרוטאזום ופירוק החלבון לפפטידים (מקטעי חלבון) קצרים. (6) מיחזור האוביקוויטין.
אוביקוויטין במצבי מחלה
מעורבות מערכת האוביקוויטין בבקרת הכמות ובפירוק מגוון רחב כל-כך של חלבונים, והשתתפותה בתהליכים בסיסיים רבים בתא, מסבירה מדוע לכל סטייה ותקלה בה עלולה להיות השלכה על פעילות התא, לא מפתיע לכן כי הפרעות אלו מתבטאות לעתים במחלות - תורשתיות ונרכשות כאחד. יש להניח כי חלק מן ההפרעות אינו מגיע אף לידי ביטוי במחלות, שכן הן מסתיימות במות העובר. המצבים הפתולוגיים יכולים להתאפיין באובדן פעילות באנזים או בחלבון עליו הוא פועל כתוצאה ממוטציות. למשל, מוטציה בחלבון המיועד לפירוק באזור הנקשר באופן נורמלי ל-E3 מונעת את הצמדת "סמן המוות" לאותו חלבון, וכך נמנע פירוקו על ידי הפרוטאזום. חלבון זה מצטבר והולך; אם למשל פירוקו מהווה אות לחלוקת התא, הרי שחלוקת התא מופרעת ויכולות להיות לכך השלכות קשות ביותר. מצבים פתולוגיים יכולים להתאפיין גם בפעילות יתר, הגורמת לעלייה בקצב הפירוק. שינוי במבנה חלבון, כמו למשל קישורו לחלבון נגיפי בעקבות הדבקה בנגיף, עלול לגרום למערכת המפרקת להכיר חלבון זה בטעות כחלבון המיועד לפירוק ורמתו בתא יורדת כתוצאה מפירוקו המואץ. במצבים ממאירים
אחד המנגנונים החשובים המשרתים את הגוף בהגנה מפני מחלת הסרטן הם קבוצה של חלבונים הקרויים "דכאני סרטן". חלבונים אלה רגישים לשינוי שחל בחומר הגנטי של התא, שינוי ההופך את התא לסרטני (התמרה סרטנית), וגורמים למות התא - וכך נמנעת התפתחות סרטן. אם נפגעים חלבונים אלה, נפגעת הרגישות להתמרה הסרטנית, התאים הפגועים לא מחוסלים ועלול להתפתח גידול סרטני. אחד החלבונים הממלא תפקיד מפתח בהתמרה הסרטנית הוא החלבון p53. יותר מ-50 אחוזים מן הגידולים הממאירים בבני האדם מתפתחים כתוצאה משינויים שחלים בגן האחראי על ייצור החלבון p53, שינויים המובילים לאיבוד פעילותו. בתאים נורמליים כמות חלבון זה קטנה מאוד, אך ברגע שהתא נחשף לתהליך שעלול לגרום להתמרה סרטנית, חלה עלייה מהירה בכמות p53 ובפעילותו. כתוצאה מכך התא חדל להתחלק עד שהנזק מתוקן. במקרים שבהם אין הנזק ניתן לתיקון, החלבון p53 גורם לתאים הפגועים להתאבד (וראו: כרוניקה של מוות מתוכנן מראש, גליליאו 28, עמ' 16). בשני המקרים מונע החלבון את התפתחות התהליך הסרטני.
מי שקוצב את כמות החלבון p53 בתאים הנורמליים היא מערכת האוביקוויטין האחראית על פירוקו המהיר. כאשר התא נחשף למצבים שפעילותו ההגנתית של p53 נחוצה בהם, החלבון הופך יציב ומצטבר במהירות. המפתח לייצובו הדרמטי הוא חסימתו בפני מערכת האוביקוויטין.
דוגמה לאחד התהליכים הממאירים הקשורים במערכת האוביקוויטין הוא התפתחות סרטן צוואר הרחם הנגרם על ידי נגיף הפפילומה. הנגיף, שמתרבה ברקמת רירית צוואר הרחם, מייצר חלבון שנקשר לחלבון p53. קישור זה גורם לכך שהחלבון p53 מזוהה על ידי מערכת הפירוק, שמצמידה אליו את "סמן המוות" - האוביקוויטין. בעקבות ההצמדה מפורק p53 במהירות. סילוקו מונע מתאים פגועים למות, והתאים הממאירים מצטברים ברקמה וגורמים להתהוות סרטן צוואר הרחם. ואכן, אפשר לראות מתאם (קורלציה) ברור בין פירוקו של p53 (הקשור לחלבון שמייצר הנגיף), לבין התפתחות סרטן צוואר הרחם.
מחקרים ראשונים מראים כי p53 יכול להופיע במספר צורות. נשים הנושאות את הצורה היותר רגישה שלו, זו המתקשרת ביתר קלות לחלבון הנגיף, עשויות לפתח סרטן בצוואר הרחם ביתר קלות. נציין כי מדובר בממצאים ראשוניים בלבד.
דוגמה אחרת של התפתחות תהליך סרטני שבו מעורבת מערכת האוביקוויטין היא סרטן המעי הגס. בסרטן זה ממלא החלבון ביתא-קטנין תפקיד חשוב בהעברת אותות להתמיינות רקמת החיפוי (האפיתל) של המעי הגס. ביתא-קטנין יוצר תצמיד גדול עם שלושה חלבונים הממוקמים ברקמת המעי הגס, שאחד מהם מצמיד לו מולקולות זרחן. בצורתו המזורחנת מכירים אותו חלבוני מערכת האוביקוויטין שמצמידים אליו את "סמן המוות" ומביאים לחיסולו - זהו המצב התקין בו נשמר ביתא-קטנין כל הזמן ברמה נמוכה המספיקה לפעילות תקינה של המערכת. בעקבות מוטציות באתרי הזרחון, מערכת האוביקוויטין שוב אינה מכירה את הביתא-קטנין, זרחונו נמנע והוא מצטבר בתאי המעי הגס. החלבון המצטבר נקשר לגורמי שעתוק שהופכים פעילים כתוצאה מהקישור. הם נודדים לגרעין וגורמים לשעתוק של גנים החיוניים כנראה להתמרה הסרטנית של תאי המעי הגס.
ובמחלות גנטיות
המחלה סיסטיק פיברוזיס (CF) נגרמת על ידי מוטציה בגן המקודד יצירת חלבון הממוקם בקרומית התא, שם הוא מתפקד כתעלית המאפשרת מעבר יונים. גם החלבון שעבר מוטציה יכול היה לתפקד כתעלית אילו ניתנה לו ההזדמנות להגיע לייעודו - לקרומית התא. אלא שמערכת האוביקוויטין מזהה את החלבון בעל המוטציה כחלבון לא תקין ומפרקת אותו במהירות וביעילות עוד טרם הגיעו ליעדו. לפיכך תאי החולים בסיסטיק פיברוזיס נעדרי תעליות מתפקדות. כתוצאה מכך חלות הפרעות קשות במאזן היונים של הגוף, מצטברים נוזלים בריאות ובבלוטות מערכת העיכול ונוצרים קשיים בתפקודי הריאות והלב המביאים בסופו של דבר למות החולה. תסמונת אנגלמן (Angelman syndrome): מחלה תורשתית המאופיינת בפיגור שכלי, צחוק בלתי נשלט וצורת הילוך חריגה. בחולים נמצאה מוטציה באנזים מצמד אוביקוויטין, אולם חלבוני המטרה המצומדים על ידו לא זוהו עדיין. הצטברותם של חלבונים מסתוריים אלה כנראה רעילה לתאי המוח המתפתחים של העובר, והנזק הנגרם להם מביא לפיגור בהתפתחות השכלית והתנועתית.
תסמונת לידל (Liddle syndrom): מחלה תורשתית המאופיינת בלחץ דם גבוה. המחלה נגרמת עקב מוטציה בחלבון המשמש בתאי הכליות כתעלית דרכה עוברים יוני נתרן. מדי יום מסננות שתי כליותיו של אדם עשרות ליטרים של תסנין - תמיסה מימית המכילה מלחים רבים, אך בסופו של דבר כמות השתן המוטלת ביממה על ידי אדם ממוצע נעה בין ליטר אחד לשניים. סינון נפח גדול כל כך נדרש על מנת לסלק מן הגוף חומרים רעילים רבים שהצטברו במהלך חילוף החומרים. לאחר הסינון שואבת הכליה בחזרה את מרבית המלחים והמומסים האחרים, והמים חוזרים בעקבותיהם, ואילו בתסנין נותרים החומרים הרעילים והמיותרים. תסמונת לידל נובעת ממוטציה בגן המקודד את חלבון התעלית, כך שמערכת האוביקוויטין שוב אינה מזהה את חלבון התעלית. התוצאה היא שמצטברות תעליות רבות שאינן מתפרקות, ויש שאיבת יתר של יונים והחזרה עודפת של מים. עליית נפח המים במחזור הדם היא היא הסיבה לעליית לחץ הדם.
תיווך חיוני בבעלי החיים
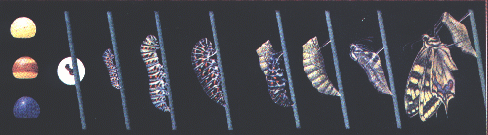
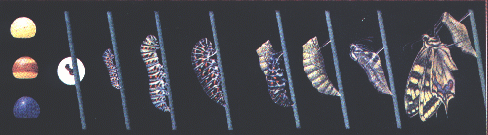
מעבר למחלות מעורבת מערכת האוביקוויטין גם בתהליכים התפתחותיים. אחת הדוגמאות המעניינות היא הגלגול זחל, גולם, פרפר. הזחל מצויד בשרירים מפותחים בגבו המאפשרים לו זחילה יעילה על העלים מהם הוא ניזון. לעומתו, לפרפר הבוגר יש שרירי כנפיים מפותחים המאפשרים את תעופתו. כיצד עובר התפקיד ממערכת שרירים אחת לשנייה בהתאם לתפקיד שעליהם למלא? מסתבר כי על "חלוקת התפקידים" הזאת אחראית מערכת האוביקוויטין. במהלך ההתפתחות, בתיווכה של מערכת האוביקוויטין, מתפרקים חלבוני שריר הגב של הזחל, ואבני הבניין - חומצות האמינו - משמשות עתה ליצירת שרירי הכנף בפרפר הבוגר.דוגמה אחרת קשורה בהתפתחות הלובסטר. סרטן הגדל במימיו הקרים של צפון האוקיינוס האטלנטי. במהלך התפתחותו עובר סרטן זה מספר מחזורים בהם הוא משיל את מעטה גופו, ומפריש מעטה חדש המתאים למידותיו שגדלו.בתהליך הנשל בו "מטייל" הסרטן החוצה מביתו הקשיח, הוא נתקל בבעיה: הוא אינו מסוגל להוציא את שרירי הלסתות העבים שלו דרך המפרקים הדקים המחברים אותם לגופו. על מנת להתגבר על בעיה זו, ובעזרתה של מערכת האוביקוויטין, מתפרקים חלבוני שרירי הלסת, השרירים נעשים דקים יותר וכך מתאפשר מעברם דרך הפרק. בתום התהליך מיוצרים מחדש חלבוני השריר, השריר מתעבה וחוזר לתפקודו הקודם. בתקופה בין הנשלים, כאשר שריריו של הסרטן מנוונים, הוא מוצא לעצמו מחבוא מתחת לחול שבמימי האוקיינוס.

התגובה החיסונית-דלקתית
שתי דוגמאות מעניינות מצביעות על קשר בין מערכת האוביקוויטין לבין נגיפים. נגיף אפשטיין-בר (EBV) מקודד יצירת חלבונים רבים, ביניהם חלבון המכונה EBNA-1. בניגוד לחלבונים אחרים של הנגיף, חלבון זה אינו מוכר לתאי מערכת החיסון, הלימפוציטים. כדי שיוכר כחלבון זר צריך לבקע אותו על ידי מערכת האוביקוויטין. מסתבר שלחלבון הנגיפי יש אתר בקצהו המקנה לו עמידות בפני המערכת המפרקת. הוא אינו מוכר על ידי האנזימים המצמדים, לא עובר את הביקוע ונשאר יציב. עמידות זו של החלבון הנגיפי, הממלא תפקיד מפתח בהתרבות הנגיף, תורמת ככל הנראה לתופעות הפתולוגיות של המחלה.
נגיף הציטומגלו, CMV, מקודד יצירת שני חלבונים נגיפיים המונעים מתאי מערכת החיסון לתקוף את הנגיף, בשל פירוק אחד ממרכיביה על ידי מערכת האוביקוויטין. פירוק זה מונע מן המערכת החיסונית לפעול כנגד הנגיף. מחלות ניווניות של עצבים ושרירים
בחולים במחלות ניווניות של מערכת העצבים המרכזית, כמו אלצהיימר, פרקינסון, קרויצפלד-יעקב ועוד, מתגלית הצטברות של תצמידי אוביקוויטין באזורים שונים של התאים. אף שבשלב זה הממצאים ראשוניים, ייתכן שיש בהם כדי לרמוז על פגם אפשרי באחד מאנזימי המערכת, או על שינוי שמתרחש בחלבונים שעליהם פועלת מערכת האוביקוויטין, שינוי שעושה אותם עמידים בפני פירוק.
אובדן ניכר של מסת שרירים מתרחש במצבים פתולוגיים שונים כמו למשל ברעב, בסוכרת, במחלות זיהומיות, בהלם (למשל לאחר תאונה) ועוד. איבוד מסת השרירים נגרמת כתוצאה מפירוק מואץ של חלבונים באמצעות מערכת האוביקוויטין. ברור היום כי אנזימי ההצמדה וגם הפרוטאזום מעורבים בתהליך. מהות האות החוץ-תאי והמסלולים המשפעלים את מערכת האוביקוויטין כתגובה למצבים הפתולוגים האלה עדיין לא ברורים. * * *
בשנים האחרונות הושגה התקדמות משמעותית בהבנת מעורבות מערכת פירוק החלבונים התלויה באוביקוויטין בבקרת תהליכי התא. נראה שמערכת זו חיונית להבטחת ההתקדמות והזרימה החד-כיוונית של התהליכים הקשורים במחזור חיי התא ובהתפתחות. היום חוקרים את המערכת הזאת מאות מדענים ברחבי העולם, קרוב ל-10,000 מאמרים מדעיים התפרסמו בנושא, ספרים רבים נכתבו עליו וכשבעה כינוסים מדעיים מוקדשים לו מדי שנה. בשנת 1994 קיבל אברהם הרשקו את פרס ישראל על הגילוי החשוב.