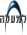מבנה מולקולתי ותיפקוד תעלת המים
בידוד החלבון האחראי למעבר המים דרך קרום התא הוביל עד מהרה לאיפיון מבנהו המולקולתי [1]. בדומה לתעלות אחרות, חלבון זה, המכונה אקוואפורין הוא הומוטטרמר המצוי בין שתי שכבות הפוספוליפידים של קרום התא [2]. האקוואפורין נוצר משרשרת חלבונית אחת החוצה את הממברנה שש פעמים (six domains), והקצוות הקרבוקסי והאמיני נמצאים בצד התוך-תאי [4-2] (תרשים 1). מולקולות האקוואפורין הן בעלות ציר סימטרי הנמצא במרכז השרשרת החלבונית והמחלק אותה לשני חצאים בעלי דימיון רב אחד לשני והאזורים הטרנסממברנתיים של סוג ה-AQPs מפגינים זהות גבוהה מאוד [3, 4]. כל ה-AQPs הם בעלי רצף של 3 חומצות אמינית אופייניות Asn-Pro-Ala (NPA) בלולאות B ו-E [4] (תרשים 1). רצפים אלה חשובים ליצירת הנקב דרכו עוברת מולקולת המים. מוטאציות בשייר NPA גורמות לאיבוד יכולתו של חלבון זה לתפקד כתעלת מים. כפי שניתן לראות בתרשים 1 בקרבת שייר NPA מצויה חומצה אמינית אופיינית ציסטאין (Cys) המקנה לתעלת המים רגישות לכספית, הידועה כמעכבת מרבית האקוואפורינים [4]. החלפת ה-Cys בחומצה האמינית סרין גורמת להעלמות הרגישות לכספית. בניגוד לקטעים הקרומיים, הקצה הקרבוקסי של ה-AQPs משתנה מתעלה לתעלה וממין למין. שונות זו מרמזת שאזור זה של החלבון איננו חשוב לתיפקוד תעלות המים, ואכן חיתוך פרוטיאוליטי של הקצה הקרבוקסי אינו משנה את מוליכות האקוואפורין למים. בחלק מתעלות המים מהווה קצה זה אתר זירחון של קינאזות, כמו פרוטאין קינאזה A, המהווה שלב חשוב בתהליך הניתוב של AQPs אלה ממאגרים תוך-תאיים אל הקרום הציטופלזמי [4] (ר' המשך). 
תרשים 1: דגם המתאר את מבנה האקוואפורין. א: שרשרת חלבונית הכוללת את ששת הדומנים החוצים את הממברנה וכוללים רצף ייחודי של חומצות אמיניות החיוניות ליצירת הנקב שדרכו עוברים המים. ב: הקונפיגורציה של האקוואפורין כמונומר. ג: המצב הטטראמירי שנמצא בו האקוואפורין בממברנה.
למרות שכל ה-AQPs הם בעלי מבנה זהה, קיימת שונות במידת מוליכותם למים מחד גיסא ובמידת העדפתם מים על פני מומסים קטנים אחרים, מאידך גיסא. בעוד שחלקם ברירני למים, חלקם מוליך גם גליצרול או שיינן [5, 6]. בניגוד לתעלות יוניות הנפתחות לסירוגין, משערים שה-AQPs פתוחות כל הזמן ואינן נתונות לבקרה הורמונית. יוצאת דופן היא תעלת המים אקוואפורין-2 (AQP-2) חריגה, כיוון שהיא נתונה לוויסות על-ידי ארגינין ואזופרסין (AVP) (ר' המשך) [5]. עד כה אופיינו וזוהו עשר תעלות מים ביונקים (טבלה 1).
טבלה 1: אתרי נוכחות ותיפקוד פיזיולוגי של תעלות מים
| שם התעלה | כינויים אחרים | טרנספורט | רגישות לכספית | פיזור רקמתי | תפקיד |
|---|---|---|---|---|---|
| AQP-0 | MIP 26, GAP proteins | מים, סוכרוזה, KCI, אסקורבאט | + | עדשות העין | מאזן נוזלים בלשכת העין |
| AQP-1 | CHIP 28 | מים, גליצרול | + | רוב הרקמות ובמיוחד באבובית הקריבנית, לולאת הנלה | ספיגת מים על-ידי הכיליה, יצירת humor aqueous בעין, יצירת CSF במוח, הרטבות דרכי הנשימה |
| AQP-2 | AQP-CD, WCH-CD | מים ו-+H | + | צינור מאסף השתן בכיליה | ספיגת המים בצינור מאסף השתן בכיליה. |
| AQP-3 | - | מים, גליצרול, שיינן | + | כיליה, עין | מעבר של מים במאסף השתן בכיליה ושמירה על שקיפות קרנית העין |
| AQP-4 | MICW | מים | - | כיליה, מוח, ריאה, עור, לב, מעיים | יצירת CSF במוח, מעבר נוזלים במאסף השתן בכיליה, יצירת humor aqueous בעין, הרטבת דרכי הנשימה. |
| AQP-5 | - | מים | + | בלוטות הרוק, submandibular, parotid, sublingual, lacrimal, קנה נשימה, עין, ריאות | הפרשת נוזלים על-ידי בלוטות האקסוקריניות |
| AQP-6 | hKID, AQP2L WCH3 | מים | + | כיליה | מעבר מים בכיליה |
| AQP-7 | - | מים, שיינן, גליצרול | - | אשכים, כיליה, לב | שימור תאי זרע |
| AQP-8 | - | מים | + | כבד, לבלב, כרכשת, בלוטות רוק | הפרשת מיצי ונוזלי הלבלב |
| AQP-9 | - | מים, שיינן | - | ליקוציטים, כבד, ריאה, טחול | מעבר שיינן בתאי הכבד |
(MIP 26) AQP-0
AQP-0 היא תעלת המים הראשונה שבודדה מעדשת העין של פרה ונקראה (MIP) major intrinsic protein [7]. תעלה זו שהיא חלבון בעל משקל מולקולתי של 26 ק"ד מהווה כ-40%-60% מהכמות הכוללת של חלבוני הקרום בתאי העדשה הסיביים (lens fiber cells) [6]. למרות שבתחילה נחשבה AQP-0 לחלבון gap junction או כפי שקרויה connexin, מסתבר שחלבון זה מתפקד כתעלת מים לכל דבר [8]. AQP-0 נמצאת רק בעדשה וככל הנראה ממלאת תפקיד חשוב במעבר מים והזנת תאים אלה המאופיינים על-ידי העדר כלי-דם לשם שמירה על שקיפותם. יתר-על-כן, AQP-0 היא כנראה בעלת תפקיד חשוב באגירת מים על-ידי העדשות ובהתפתחות ירודים (תופעות שכיחות בהזדקנות). לאחרונה דווח שמוטאציה בגן המקדד את ה-AQP-0 גורמת לירודים תורשתיים בעכברים [9]. AQP-1 או CHIP-28
זו תעלת המים הברירנית הראשונה שנתגלתה בכדוריות דם אדומות על-ידי Agre וחב' [10] ונקראה גם channel forming integral membrane protein. רצף הבסיסים בגן המקדד את
ה-AQP-1 ורצף חומצות אמיניות המרכיבות תעלה זו (שמשקלה המולקולתי 28 ק"ד), מראים זהות גבוהה עם AQP-0 [8]. AQP-1 שנמצאת כהומוטטראמיר תורמת להישרדות כדוריות הדם האדומות בנימיות במדולה של הכיליה (vasa recta), אתר המאופיין על-ידי אוסמולריות גבוהה ביותר. AQP-1 מתבטא ברקמות רבות, כמו כיליה, בלוטות הרוק, הלב ותאי האנדותל המרפדים את הדופן הפנימי של הקרנית [6, 8]. מיקום תעלה זו בעין מלמד על תיפקוד אפשרי במעבר מים מהרשתית ללשכת העין. AQP-1 נמצא גם בתאי האנדותל של הנימיות בבלוטת הרוק, lacrimal gland, הלבלב והלב, אך לא נמצא בתאי האפיתל של בלוטות אלה [11]. יתר-על-כן, AQP-1 תורם להיווצרות ה-CSF במוח ובחוט השדרה [6, 8]. AQP-1 נמצא בשפע ברקמת הכיליה כפי שהוכח על-ידי שיטות Northern blot ו-immunohistochemistry. צפיפות גבוהה במיוחד של AQP-1 נתגלתה באבובית הקריבנית ולולאת הנלה היורדת הדקה - שני אזורי הנפרון האחראים לספיגת 90%-80% מסה"כ כמות המים העוברת סינון בכיליה [6]. קטעים אלה ידועים בחדירותם הגבוהה למים וככל הנראה AQP-1 תורם לתכונה זו. לעומת זאת, AQP-1 לא נמצא בתאי האפיתל של לולאת הנלה העולה או האבובית הרחיקנית, קטעים הידועים באטימותם בפני מעבר מים. באבובית הקריבנית, AQP-1 ממוקם בממברנה האפיקלית של ה-brush border והממברנה הבאזולאטרלית [12]. בדומה לאבובית הקריבנית, AQP-1 נמצא הן בממברנה האפיקלית והן בממברנה הבאזולטרלית של תאי האפיתל בלולאת הנלה היורדת [6]. מעניין שתעלה זו נמצאת בשפע גם בתאי האנדותל של ה-vasa recta היורדים, תכונה המקנה לכלי-דם אלה חדירות גבוהה למים. בנוסף לכיליה, AQP-1 מעורבים בבקרת נפח הנוזלים האינטרסטיציאלי, הרטבת דרכי הנשימה ופינוי הנוזלים מאבוביות הריאה [6, 8]. אחת התכונות האופייניות לתעלת AQP-1 היא שהיא מתבטאת בצורה מתמדת (קונסטיטיוטיבית) ברקמות המצוינות לעיל ואיננה נתונה לבקרה הורמונית. AQP-2 או AQP-CD
זו תעלת המים השנייה שבודדה ואופיינה ביונקים [13]. AQP-2 היא בעלת הומולוגיה של 42% ל-AQP-1 ונמצאת רק בתאי האפיתל של מאסף השתן אך לא באבובית הקריבנית [6, 8, 14]. AQP-2 ממוקמת בעיקר בצד האפיקלי של תאי מאסף השתן הנתונים לבקרה של ארגינין ואזופרסין (AVP) לגבי מידת חדירותם למים [14, 15]. על-ידי שימוש באלקטרון מיקרוסקופ הראו במספר עבודות שבמאזן נוזלים תקין, נמצאות רוב מולקולות ה-AQP-2 בבועות ציטופלזמיות המפוזרות בצד התת-אפיקלי של הממברנה [6, 8, 14, 16]. בועות אלו (כל שלפוחית מכילה כ-5200 מולקולות של AQP-2) עוברות טרנסלוקציה והשתבצות בממברנה האפיקלית של ה-inner medullary collecting duct (IMCD) בתגובה לגירוי על-ידי AVP [17, 18]. ממצא זה מלמד ש-AQP-2 מהווה אמצעי שדרכו מווסת AVP את המעבר של מים במאסף השתן מחד גיסא ומאשר אמיתות "shuttle hypothesis" המתייחסת ל-trafficking (ניתוב) של תעלות המים בתיווך ה-AVP מאידך גיסא (ר' תמונה 2). תהליך ההעתקה של הבועיות המכילות AQP-2 מורכב ומעורבים בו מספר רב של יסודות שטבעם עדיין לא הוסבר במלואו. אולם, ידוע שמעכבי חלבוני ה-cytoskeleton פוגעים בתהליך ההעתקה של AQP-2, מה שמלמד שחלבונים אלה ובעיקר dynein, dynactin ו-myosin מעורבים בתהליך זה [6, 8]. בנוסף לטרנסלוקציה של AQP-2 בתגובה ל-AVP, מגביר הורמון זה גם את הביטוי של mRNA AQP-2 במאסף השתן כפי שנצפה בחולדות נטולות מים במשך 48 שעות או בחולדות מזן Brattleboro (אינן מייצרות AVP) שקיבלו הזרקות של AVP לתקופה ממושכת [6, 16, 19]. תצפית זו מלמדת, ש-AVP מגביר לא רק את ה-shuttling של AQP-2 אלא משרה גם ייצור AQP-2 בתנאי חוסר מים, דבר המביא לעלייה בחדירות מאסף השתן, מנגנון המקנה לבעלי-חיים ואדם היכולת לרכז את השתן בתנאים אלה. אפקט זה של AVP מתווך על-ידי קולטנים מסוגי V2 הנמצאים בשפע בצד הבאזולאטלרי של תאי מאסף השתן [20]. 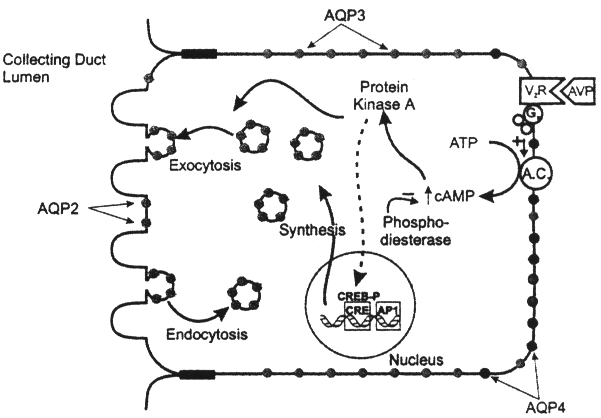
תרשים 2:בקרת החדירות למים של תאי האפיתל של מאסף השתן. בהעדר ואזופרסין מצויות מעט תעלות AQP-2 בממברנה האפיקלית, דבר המגביל את ספיגת המים מחלל הנפרון. AQP-3 ו-AQP-4 מתבטאות בממברנה הבאזולאטלרית בצורה מתמדת. בנוכחות ואזופרסין (AVP) המתקשר ל-V2 הנמצא בממברנה הבאזולאטלרית ומשפעל אדנילאט ציקלאזה עולות רמות ה-cAMP בציטוזול. דבר זה מביא להפעלת הפרוטאין-קינאזה מסוג A המזרחן את המאגרים התוך-תאיים של AQP-2 ומביא להעתקתם אל הממברנה האפיקלית, מה שמעלה את חדירותה למים בצורה משמעותית.
הפעלת V2 לאחר קשירת AVP, מביאה לעלייה ברמות ה-cAMP הציטוזולי המהווה שליח משני של הורמון זה בקטעים המרוחקים של הנפרון. לאחרונה הוכח קיום cAMP-responsive element בגן המקדד את ה-AQP-2, דבר המעיד ש-AVP מזרז את הביטוי של תעלות אלו ברמת שיעתוק הגן [8]. בעבודות המשתמשות בשיטות ה-micropuncture הודגם ש-20% מהתסנין הפקעיתי נספגים בקטעים הרחיקניים של הנפרון ככל הנראה בתיווך AQP-2 שכאמור נמצאים בשפע במאסף השתן הקליפתי והמדולרי [6, 8, 14, 15].
AQP-2 נמצאים בשתן של אנשים בריאים אך לא בחולים הלוקים ב-NDI - nephrogenic diabetes insipidus [21] (ר' פתופיזיולוגיה של תעלות מים). עד היום לא נמצאו תעלות מים נוספות הנתונות לבקרת AVP. בשלפוחית הקרפדה, המהווה את האיבר האוסמורגולטורי העיקרי בחיה זו ודגם אמין ומקובל על חוקרים רבים המתעניינים בתעלות מים והשפעות AVP על מאסף השתן ביונקים, קיימות תעלות מים המושרות על-ידי AVP המכונות AQP-TB הדומים ל-AQP-2 בנוסף לתעלות מסוג AQP-1 הנמצאות באורח קבוע (קונסטיטוטיבי) ברקמה זו [8].
AQP-3
AQP-3 בודדה לראשונה מכיליית חולדה והיא מעבירה בנוסף למים גם גליצרול ושינן [22]. בנוסף לכיליה, מתבטאת AQP-3 גם בדרכי העיכול (קיבה, מעי דק וכרכשת) [6, 8]. למרות שספיגת המים וההפרשות במעיים לא הובהרו בצורה מלאה, AQP-3 תורמת לתהליכים אלה יחד עם AQP-8 (ר' בהמשך). בשיטות immunohisto-chemistry הודגם ש-AQP-3 ממוקמת בממברנה הבאזולאטרלית של תאי מאסף השתן, ובניגוד ל-AQP-2 היא אינה נמצאת בבועות תוך-תאיות [5, 6, 8, 23]. בעוד שמספר חוקרים [6] הראו ש-AQP-3 מתבטאת גם בתאי האפיתל של קנה הנשימה, תאי המזנגיום, המוח ותאי האפיתל והלחמית בעין, במחקרים אחרים [6, 8] לא הצליחו להוכיח קיום AQP-3 מלבד בכיליה. AQP-3 בכיליה נמצאת בעיקר במדולה החיצונית ובקליפה ובכמויות זעומות במדולה הפנימית [6, 8]. העדר AQP-3 במאגרים תוך-תאיים מלמד שתעלה זו אינה נתונה להעתקה מבועות תוך-תאיות אל הממברנה הבאזולאטלרית. בתנאי יובש בחולדות, רמות ה-mRNA של AQP-3 והחלבון האימונוראקטיבי עולות בצורה מתונה בכיליה בהשוואה לעלייה החדה בכמות AQP-2, מה שמלמד על תרומה מוגבלת של AQP-3 לתהליך ריכוז השתן [6, 8, 23]. AQP-4
תעלה זו בודדה לראשונה מריאות ומוח של חולדות [24]. בניגוד ל-AQP-1, AQP-2 ו-AQP-3, תעלה זו איננה רגישה לכספית. צפיפות משמעותית של AQP-4 נמצאת במוח ומשערים שהיא ממלאת תפקיד חשוב בתהליך יצירת ה-CSF [6, 8]. צביעה בעזרת נוגדנים הוכיחה קיום AQP-4 גם בעין, בכיליה ובמעיים [8]. בכיליה ממוקמת AQP-4 בממברנה הבאזולטלרית של תאי מאסף השתן המדולריים, אך לא במאגרים תוך-תאיים או בממברנה האפיקלית של תאים אלה [6]. AQP-4 נמצאת באותם אתרים שמצויה בהם AQP-3, מה שמצביע על תיפקוד דומה של תעלות אלו בוויסות ספיגת המים ושמירה על רטיבות תקינה ברקמות אחרות, כמו הריאות והעין. בדומה ל-AQP-3, מתבטאת AQP-4 בצורה מתמדת באיברים המוזכרים לעיל ואיננה נתונה לבקרה הורמונית.
AQP-5
תעלה זו בודדה לראשונה מבלוטות הרוק [25]. הביטוי של AQP-5 שכיח בבלוטות הרוק, בקרנית העין והריאות, מה שמאותת על תיפקוד אפשרי בתהליך הפרשת מים ברקמות אלו. Immunstaining הראתה ש-AQP-5 ממוקמת בממברנה האפיקלית של התאים המפרישים של הבלוטות התת-ליסתיות, התת-לשוניות והדמעות [25]. בריאות נמצאת AQP-5 בתאי האפיתל מסוג type I של הבועיות [6, 8], ומשערים שבתקופה העוברית תעלה זו ממלאת תפקיד במעבר מים בין מדורי הנוזלים האמניותי והאינטרסטיציום של הריאות. תעלת AQP-5 אינה נמצאת בכליות, דבר המצביע על מעורבותה בתהליכי הפרשה אקסוקריניים אך לא בתהליך ריכוז השתן [6, 8]. AQP-6
תעלה זו המכונה גם WCH-3 או hKID בודדה לראשונה מכיליות אדם וחולדה [26], היא בעלת הומולוגיה ל-AQP-2, אך מוליכותה למים קטנה מזו של רוב האקוואפורינים האחרים. הגן המקדד את AQP-6 נמצא על כרומוזום 13, בקרבת הגנים המקדדים AQP-0, AQP-2 ו-AQP-5, מה שמצביע על קירבה אבולוציונית ביניהם [27]. AQP-6 מתבטאת רק בכיליה בדומה ל-AQP-2 [27]. התפקיד המדויק של AQP-6 אינו ברור, אך קיומה בקליפה ובמדולה של הכיליה מרמז על תרומה אפשרית בתהליכי מעבר המים ברקמה זו. השערה זו נתמכת על-ידי הממצא שרמות AQP-6 בכיליה עולות בחולדות הנתונות למחסור במים, בדומה למה שנצפה בתעלות AQP-2 ו-AQP-3 הידועות בתרומתן העיקרית בתהליכי ספיגת מים על-ידי הכיליה [6, 8]. AQP-7
תעלה זו היא בעלת 269 חומצות אמיניות ובודדה לראשונה מאשכים של חולדה [28]. עקב ההומולוגיה הגבוהה (48%) בינה לבין AQP-3, מעבירה AQP-7 בנוסף למים גם גליצרול ושיינן. אנליזה באמצעות Northern blot הראתה ביטוי של AQP-7 באשכים, בכליות, בלב ובמידה פחותה בתאי שריר שלד ומוח [6]. באשכים, נמצאה AQP-7 בתאי ספרמטידים בשלים והיא איננה רגישה לכספית, דבר המסביר את העדר רגישות תאי הזרע לכספית. תפקידה הפיזיולוגי של AQP-7 בזרע איננו ידוע, אך חדירותה לגליצרול היא בעלת יישום בשימור תאי זרע כאשר גליצרול הוא cryoprotectant [8]. בנוסף לתאי זרע, נמצאת AQP-7 גם ברקמת שומן של אדם ומשערים שהיא משמשת כמסלול מעבר לגליצרול [6]. בכיליה ממוקמת AQP-7 בתאי ה-brush border של האבובית הקריבנית הישרה אך לא המפותלת [6]. התפלגות זו שונה מזו של AQP-1 שמפוזרת לאורך האבובית הקריבנית בצורה הומוגנית. תפקיד AQP-7 במעבר מים בקטע זה של הנפרון, עדיין לא הובהר. AQP-8
AQP-8 הרגישה לכספית אופיינה באשכים, בלבלב ובכבד של חולדה ובריאות ובשיליה של עכבר [6, 29]. תעלה זו נמצאת בתאי הכבד ובתאי אוניות הלבלב, בבלוטות הרוק ובתאי הכרכשת. AQP-8 היא תעלת מים ברירנית שאיננה מעבירה גליצרול או שיינן [6, 8]. פיזור וביטוי AQP-8 בלבלב מלמד על תיפקוד אפשרי של תעלה זו בהפרשת נפחים גדולים של מים (מיצי הפרשה) על-ידי איבר אנדוקריני/אקסוקריני זה. נוכחות AQP-8 בבלוטות הרוק מרמזת על תיפקוד הפרשתי בעוד שבכרכשת תעלות אלו תורמות לספיגת מים [6, 8]. לעומת זאת, הביטוי של AQP-8 בכיליה הוא מזערי ביותר [6]. AQP-9
תעלת מים זו, שבודדה לראשונה מתאי כבד, היא האחרונה שנתגלתה עד כה [30]. AQP-9 היא בעלת דמיון רב ל-AQP-7 (45%). תעלה זו מתאפיינה בכך, שמעבירה מים ושיינן אך לא גליצרול [6], מה שמלמד שאקוואפורינים יכולים להבדיל בין המומסים הלא-יוניים הקטנים. AQP-9 מתבטאת בעיקר בליקוציטים מדם היקפי ובמידה פחותה בכבד, בריאה ובטחול [6, 30]. החדירות הגבוהה של תעלה זו לשיינן מרמזת ש-AQP-9 מתפקדת כמנגנון יעיל לסילוק שיינן מתאי הכבד. פתופיזיולוגיה של תעלות מים
במחקרים רבים דווח, שפגמים ביצירת או בפעילות תעלות מים מסוימות יכולים להוביל להפרעות בוויסות מעבר המים דרך קרומי התאים ובעקבותיהם הפרה במאזן הנוזלים בגוף או ברקמות השונות (טבלה 2). טבלה 2: מצבים פיזיולוגיים ופתופיזיולוגיים המאופיינים על-ידי שינוי בהתבטאות/פעילות אקוואפורין-2
מצבים המאופיינים על-ידי ירידה בהתבטאות אקוואפורין-2 ובעליית קצב הפרשת השתן:
א' פגמים גנטיים:
- Central Diabetes Insipidus (CDI)
- מוטאציות בגן המקדד אקוואפורין-2
- מוטאציות בגן המקדד את קולטן AVP מסוג V2
- טיפול בליתיום (Lithium)
- היפוקלמיה (Hypokalemia)
- היפרקאלציאוריה (Hypercalciuria)
- Nephrogenic Diabetes Insipidus (NDI) מחסימת שופכן חד- או דו-צדדית.
ד' שתיית מים כפייתית (Compulsive Water Drinking).
ה' אי-ספיקת כליות כרונית.
ו' אי-ספיקת כליות חדה.
ז' זיקנה.
מצבים המלווים בירידה בהתבטאות אקוואפורין-2 ללא עלייה בקצב הפרשת השתן:
א' תסמונת נפרוטית.
ב' Puromycin aminonucleoside-PAN
ג' טיפול באדריאמיצין.
ד' צמקת כבד מתונה הנגרמת על-ידי Bile Duct Ligation.
ה' אי-ספיקת כליות חדה על רקע איסכמי.
מצבים המלווים בעלייה בהתבטאות אקוואפורין-2 ואגירת מלח ומים:
א' מתן ואזופרסין או הפרשה מוגברת של ואזופרסין (Syndrome of inappropriate secretion of ADH - SIADH).
ב' אי-ספיקת לב גודשית (Congestive Heart Failure).
ג' צמקת כבד מתקדמת הנגרמת על-ידי CC14.
ד' הריון.
Agre וחב' [31] איפיינו מספר אנשים הנושאים מוטאציות תורשתיות בגן המקדד AQP-1 הגורמות להעדר תעלת מים זו בכדוריות דם אדומות ובאבובית הקריבנית. חסר AQP-1 באנשים אלה (שנתגלו באקראי על-ידי בנקי הדם ומוכרים כ-Colton null בגלל העדר החלק החוץ ממברני של AQP-1) מתבטא בהעדר תעלה זו בכיליה ובכדוריות דם אדומות דבר הגורם לירידה משמעותית בזרימת המים דרך קרום תאי הכדורית האדומה. למרות זאת שמונת האנשים שנתגלו ברחבי העולם עד כה אינם מסתמנים על-ידי תופעות קליניות משמעותיות. לעומת זאת, עכברים ללא AQP-1 (AQP-1 knockout) אינם מסוגלים לרכז שתן בתנאי יובש [32]. ייתכן שאנשים עם Colton null לוקים בתופעה דומה עקב העדר תעלות מים מסוג זה באבובית הקריבנית ובלולאת הנלה היורדת, החיונית לקיום "זרימה נגדית מתגברת", אם כי נושא זה לא נבדק עד היום. ככל הנראה העדר AQP-1 באבובית הקריבנית איננו פוגע בספיגה העצומה של מים הודות לנוכחות תעלות AQP-6 הנמצאות בשפע בקטע זה של הנפרון וממלאות תפקיד זהה לזה של AQP-1 [6, 8].
אנשים הנושאים מוטאציות ב-AQP-2, נכללים בקבוצת חולים הלוקים במצב קליני של nephrogenic diabetes insipidus (NDI), המתאפיין בהעדר תגובתיות הכיליה ל-AVP. מצב זה נגרם בין היתר על-ידי מוטאציות בכרומוזום X בלוקוס המקדד קולטני V2 [33]. אולם, חלק מהחולים עם NDI מבטאים קולטני V2 בצורה תקינה, דבר המלמד על קיום פגם תורשתי בתעלות המים מסוג AQP-2 והתורם למחלה זו. האדם הראשון שאופיין עם פגם ב-AQP-2 לקה בשתי מוטאציות אוטוזומיות רצסיביות (missense), מצב שהביא להיווצרות תעלות לא תפקודיות כפי שהוכח על-ידי בדיקת זרימת המים לאחר התבטאות תעלות אלו בביציות נטולות אקוואפורינים [23, 24]. מדידת רמות AQP-2 באמצעות Western blot בשתן של אנשים אלו מגלה ריכוזים נמוכים של חלבון זה [34]. בניגוד לאנשים הנושאים מוטאציות ב-AQP-1, מוטאנטים של AQP-2 לוקים בהפרעות קשות בכושר ריכוז השתן, דבר שיכול להוביל להפרעות נירולוגיות משניות מחמת התייבשות. כיוון ש-AQP-2 היא התעלה היחידה המתבטאת בצד האפיקלי בתאי האפיתל של מאסף השתן, העדר תעלות אלו או פגם בתיפקודן, אינו מפוצה על-ידי תעלות מים אחרות, עובדה שהביאה להתבטאות המחלה במלוא חומרתה באנשים אלה. בהשוואה ל-70 מוטאציות שזוהו עד כה בקולטני V2 ואשר יכולות להוביל ל-NDI, דווחו עד כה רק 13 מוטאציות בגן המקדד AQP-2 [33]. מוטאציות אלו פוגעות בעיקר בטרנסלוקציה של AQP-2 מהמאגרים התוך-תאיים אל הממברנה האפיקלית של מאסף השתן. ריבוי מספר המוטאציות המלוות בהפרעות תיפקודיות שונות מקשה על פיתוח טיפול ברירני באנשים הלוקים ב-NDI, אם כי טיפול גנטי יכול להיות מעשי במקרים של NDI מלידה. למרות ש-DI נירוגני נגרם על-ידי העדר ייצור והפרשת AVP, היא מלווה גם בשינוי בהתבטאות האקוואפורינים בכיליה. חולדות מזן Brattleboro, המאופיינות על-ידי העדר AVP מהוות דגם נפוץ לחקר שינויים אלה. בעוד שביטוי AQP-1 בכליות של חולדות אלו איננו מושפע, נצפתה ירידה בולטת בצפיפות AQP-2 במאסף השתן בהשוואה לחולדות בריאות [8, 23, 35]. הצפיפות הנמוכה של AQP-2 מתבטאת בהעדר יכולת לרכז שתן. מתן AVP ממקור חיצוני לחולדות Brattleboro, מביא להגברת התבטאות AQP-2, מה שמורה על קשר הדוק בין מידת ההתבטאות של תעלות אלו ורמות AVP.
כיוון שמוטאציות הגורמות לפגם במבנה או בהתבטאות אקוואפורינים באנשים - נדירות, משתמשים חוקרים העוסקים בנושא זה בעכברים החסרים סוגים שונים של תעלות מים. בהקשר זה, עכברים חסרי AQP-4 היו תקינים בזמן לידה ובעלי-יכולות לרכז את השתן בצורה כמעט תקינה בתנאים נורמליים, אם כי המוליכות של מאסף השתן בעכברים אלה הייתה 25% מזו שבעכברים בריאים [5, 8, 23]. ירידה זו במוליכות למים מסבירה את אי יכולתם לרכז את השתן בצורה מרבית בהעדר מים במשך 36 שעות (2616 vs 3342 mOsm/kg). למרות שתעלות AQP-4 ו-AQP-3 נמצאות בממברנה הבאזולאטרלית של מאסף השתן, נמצאת הראשונה בעיקר במאסף השתן המדולרי הפנימי, בעוד שהאחרונה נמצאת בקטעים קליפתיים של מאסף שתן או במדולה החיצונית. התפלגות זו מסבירה את הפגיעה המתונה ביכולת ריכוז השתן בהעדר AQP-4 בעכברים. הפגיעה המתונה בכושר ריכוז השתן בעכברים עם חסר AQP-4 בהשוואה לפגיעה הקשה באנשים עם מוטאציות ב- AQP-2 מורה, ש-AQP-3 כנראה מפצה על העדר AQP-4 ומונעת ירידה חדה ביכולת הכיליה להפריש שתן מרוכז [6, 23].
לעומת NDI הנגרם על רקע תורשתי, NDI נרכש יותר שכיח. לדוגמה, ליתיום המשמש לטיפול נרחב במחלות נפש דיכאוניות, יכול לגרום ל-NDI [6, 23]. נמצא, שמתן ליתיום לחולדות במשך 35-10 ימים במינונים מקובלים, הביא לירידה חדה בביטוי AQP-2 המלווה בהתהוות NDI חדה [36]. תצפית זו מאששת את התיפקוד של AQP-2 כמרכיב חשוב בוויסות מאזן הנוזלים בגוף מחד גיסא ותרומתו להתהוות הפרעות במשק המים במצבי חולי שונים, מאידך גיסא. מצב נוסף המלווה בשינוי בהתבטאות AQP-2 בכיליה היא היפרקלצימיה [4]. נמצא, שעלייה בכמות הסידן בתסנין המגיע אל תאי מאסף השתן במדולה הפנימית, גורמת לירידה בהתבטאות AQP-2 [4]. מניחים, שקיימים חיישני סידן בצד הנהורי של תאים אלה, המנטרים את ריכוז הסידן בשתן וברגע שקיימת עלייה בכמות הסידן בתסנין אזי AQP-2 עוברת אנדוציטוזה ועל-ידי כך מפחיתה את יכולת הכיליה לרכז שתן. תגובה זו מיועדת להגנה מפני התהוות אבני כיליה ומסבירה מדוע היפרקאלציאוריה מלווה בירידה בכושר הכיליה לרכז שתן. בדומה להיפרקאלציאוריה, היפוקלמיה מלווה אף היא בירידה בהתבטאות AQP-2 במנגנון בלתי ידוע [23].
אחד המצבים הקליניים המאופיינים על-ידי ספיגה מוגברת של מלח ומים, המלווה בהתהוות בצקות, היא אי-ספיקת לב גודשת (congestive heart failure - CHF). נוכח הירידה בצפיפות ה-AQP-2 ב-NDI, הועלתה ההשערה, שעלייה ברמות תעלה זו בכיליה תורמת לצבירה מוגברת של מים באי-ספיקת לב מתקדמת. על-ידי שימוש בדגם ניסויי של המחלה הנגרם עקב קשירת העורק הכלילי בחולדות, הדגימו Nielsen וחב' [37] ו-Xu וחב' [38] עלייה ברמות ה-mRNA של AQP-2 והחלבון במאסף השתן. חוקרים אלה דיווחו שעלייה זו נצפתה רק בחולדות עם CHF המלווה בהיפונתרמיה, אך לא בחולדות שהצליחו לשמור על מאזן מלח ומים תקינים. עיקר העלייה בצפיפות ה-AQP-2 הייתה בממברנה האפיקלית של מאסף השתן, מה שמורה על האצת העתקת המאגרים התוך-תאיים של AQP-2 אל צד זה של הממברנה. שינויים אלה מיוחדים לרמות הגבוהות של AVP בפלסמה של חולדות עם CHF. סימוכין להשערה זו נתקבלה על-ידי Xu וחב' [38] אשר הראו שחסימת קולטני AVP מסוג V2 באמצעות חסם סגולי (OPC-31260) במשך 24 שעות, בולמת את העלייה ברמות AQP-2 תוך כדי האצת קצב הטלת השתן. ממצאים דומים נתקבלו בחולדות שלקו בצמקת הכבד המלווה במיימת הנגרמת על-ידי CCI4 [39]. העלייה בצפיפות ה-AQP-2 הייתה ביחס ישיר למידת החומרה של המיימת. בדומה לממצאים שנתקבלו בחולדות עם CHF, מתן OPC-31260 לחולדות עם צמקת המלווה במיימת, הביאה לירידה ברמות ה-AQP-2 [39]. לעומת דגם זה, בצמקת הנגרמת על-ידי bile duct ligation המאופיינת בהעדר יצירת מיימת, לא נצפתה עלייה בצפיפות ה-AQP-2 במדולת הכיליה [23]. ממצאים אלה מורים ש-AQP-2 תורם תרומה משמעותית להתהוות מאזן מים חיובי המתבטא בבצקות ובמיימת ב-CHF וצמקת, בהתאמה. לעומת זאת, לא נצפתה עלייה בצפיפות ה-AQP-2 בכיליה של חולדות עם תסמונת נפרוטית, מצב קליני המאופיין אף הוא על-ידי אגירת מים [23, 40], כך שנדרשת זהירות לגבי הכללת תרומת ה-AQP-2 לכל המצבים הקליניים המאופיינים על-ידי צבירת מים.
מסקנות ותצפית לעתיד
ההתעניינות המחודשת בחקר תעלות המים בשנים האחרונות הביאה לאיפיון 10 תעלות מים בעלות תכונות משותפות ושונות. למרות שתפקידן הפיזיולוגי של רוב תעלות המים עדיין לא הובהר די הצורך, הן ממלאות תפקיד חשוב בוויסות חדירות קרומי התאים למים ועל-ידי כך שומרות על האוסמולריות האופיינית בכל אחד ממדורי נוזלי הגוף למרות תנודות יומיות בקליטת מים ומלח. נוכחות מספר סוגי תעלות מים באיברים אקסו- ואנדוקריניים מלמדת, שמבנים אלה מהווים נתיבי הפרשה לחלק ממיצי ונוזלי בלוטות אלו. אקוואפורינים בריאה ובעין הם בעלי תפקיד חשוב בהרטבת איברים אלה במצבים פיזיולוגיים. אחד האיברים העשירים ביותר בתעלות מים הוא הכיליה. בניגוד לדעה שרווחה עד כה, ספיגת המים לאורך הנפרון מתבצעת בעיקר על-ידי תעלות מים כאשר, AQP-1 ממלא תפקיד מכריע בספיגת רוב התסנין בקטעים הקריבניים של הנפרון בעוד
של- AQP-2יחד עם AQP-3 ו- AQP-4תרומה משמעותית לספיגת שאר התסנין המגיע למאסף השתן. תפקידים אלה של אקוואפורינים נתמכים על-ידי מחקרים רבים הן בבני אדם הלוקים במוטאציות הפוגעות בתעלות המים השונות והן בדגמים ניסויים בעכברים חסרי אקוואפורינים שונים. למרות ההתקדמות שחלה בתחום זה בשנים האחרונות נותרו שאלות רבות ללא מענה: מה הוא התפקיד הפיזיולוגי של סוגי התעלות השונים בכל איבר ואיבר? כיצד אנשים הלוקים בחוסר של AQP-1 מצליחים לשרוד ללא כל הפרעה קלינית? האם היעדר השפעות לוואי לחוסר AQP-1 מרמז על אי חשיבות חלבון זה או שאנשים הלוקים ב-Colton null לא נבדקו בצורה יסודית עד כה? האם AQP-3 ו-AQP-4 נתונים לבקרת AVP בדומה ל-AQP-2? האם קיימות מוטאציות ב-AQP-3 ו-AQP-4 באדם היכולות לגרום להפרעות במאזן הנוזלים או למחלות? האם אגוניסטים ואנטגוניסטים לתעלות מים יכולים להיות שימושיים בטיפול בהפרעות קליניות המלוות על-ידי מאזן מים לקוי?
ביבליוגרפיה
- Preston GM & Agre P, Isolation of the cDNA for erythrocyte integral protein of 28 Kd: member of an ancient channel family. Proc. Natl Acad Sci (USA), 1991; 88: 11110-11114.
- Engle, A. Walz T & Agre P, Structure of the aquaporin water channels. Curr Opin Struct Biol, 1994; 4: 545-553.
- Nielsen S & Agre P. The aquaporin family of water channels in kidney. Kidney Int. 1995; 48: 1057-1068.
- Zeidel ML, Recent advances in water transport. Semin Nephrol, 1998; 18: 167-177.
- Marples D, Frokiaer J & Nielsen S, Long-term regulation of aquaporins in the kidney. Am J Physiol, 1999; 276: F333-F339.
- Yamamoto T & Sasaki S, Aquaporins in the kidney; emerging new aspects, Kidney Int, 1998; 54: 1041-1051.
- Gorin NB, Yancey SB, Cline J & al, The major intrinsic protein (MIP) of the bovine lens fiber membrane. Cell, 1984; 39-59.
- Dibas AL, Mia AJ & Yorio T, Aquaporins (water channels): role in vasopressin-activated water transport. Proc Sci Exper Biol Med, 1998; 219: 183-199.
- Shiels A & Bassnett S. Mutations in the founder of the MIP gene family underline cataract development in the mouse. Nature Genet, 1996; 12: 212-215.
- Denker BM, Smith BL, Kuhajda FP & Agre P, Identification, purification, and partial characterization of a novel Mr 28,000 integral membrane protein from erythrocytes and renal tubules. J Biol Chem, 1988: 263: 15634-15642.
- Moon C, Preston GM, Griffin CA & al, The human aquaporin-CHIP gene. Structure, organization, and chromosomal localization. J Biol Chem. 1993; 268: 15772-15778.
- Nielsen S, Smith B, Christensen El & al, CHIP-28 water channels are localized in constitutively water-permeable segments of the nephron, J Cell Biol, 1993; 120: 371-383.
- Fushimi K, Uchida S, Hara Y & al, Cloning and expression of apical membrane water channel of rat kidney collecting duct. Nature, 1993; 361: 549-552.
- Nielsen S, Digiovanni SR, Christensen EL & al, Cellular and subcellular immunolocalization of vasopressin-regulated water channel in rat kidney. Proc Natl Acad Sci (USA), 1993; 90: 11663-11667.
- Fushimi K, Sasaki S, Yamamoto T & al, Functional characterization and cell immunolocalization of AQP-CD water channel in kidney collecting duct. Am J Physiol, 1994; 267: F573-F582.
- Yamammoto T, Sasaki S, Fushimi K & al, Localization and expression of collecting duct water channel, aquaporin, in hydrated and dehydrated rats. Exp Nephrol, 1995; 3: 193-201.
- Nielsen S, Chou C, Marples D & al, Vasopressin increases water permeability of kidney collecting duct by inducing translocation of aquaporin-CD water channel to plasma membrane. Proc Natl Acad Sci (USA), 1995; 92: 1013-1017.
- Yamamoto T, Sasaki S, Fushimi K & al, Regulation of collecting duct water channel expression by vasopressin in Brattleboro rat. Proc Natl Acad Sci (USA), 1994; 91: 8984-8988.
- Digiovanni SR, Nielsen S, Christensen El & al, Regulation of collecting duct water channel expression by vasopressin in Brattleboro rat. Proc Natl Acad Sci (USA), 1994; 91: 8984-8988.
- Hayashi M, Sasaki S, Tsuganezawa H & al, Expression and distribution of aquaporin of collecting duct are regulated by vasopressin V2 receptor in rat kidney, J Clin Invest, 1994; 94: 1778-1783.
- Kanno K, Sasaki S, Hirata Y & al, Urinary excretion of aquaporin-2 in patients with diabetes insipidus. N Engl J Med, 1995; 332: 1540-1545.
- Echevarria M, Windhager E.E. Tate SS & Frindt G, Cloning and expression of AQP-3, a water channel from the medullary collecting duct of rat kidney. Proc Natl Acad Sci, 1994; 91: 10997-11001.
- Nielsen S, Kwon T-H, Monster B & al, Physiology and pathophysiology of renal aquaporins,. J Am Soc Nephrol, 1999; 10: 647-663.
- Hasegawa H, Ma T, Skach W & al, Molecular cloning of a mercurial-insensitive water channel expressed in selected water-transporting tissues. J Biol Chem, 1994; 269: 5497-5500.
- Raina S, Preston GM, Guggino WB & Agre P, Molecular cloning and characterization of an aquaporin cDNA from salivary, lacrimal, and respiratory tissues. J Biol Chem, 1995; 270: 1908-1912.
- Ma T, Frigeri A, Skach W & al, Cloning of a novel rat kidney cDNA homologous to CHIP28 and WCH-CD water channels. Biochem Biophys Res Commun, 1993; 197: 654-659.
- Ma T, Yang B, Kuo WL & Verkman AS, cDNA cloning and gene structure of a novel water channel expressed exclusively in human kidney; evidence for a gene cluster of aquaporins at chromosome locus 12q13. Genomics, 1996; 35: 543-550.
- Ishibashi K, Kuwahara M, Gu Y & al, Cloning and functional expression of a new water channel abundantly expressed in the testis permeable to water, glycerol, and urea. J biol Chem, 1997, 272: 20782-20786.
- Koyama Y, Yamamoto T, Kondo D & al, Molecular cloning of a new aquaporin from rat pancreas and liver. J Biol Chem, 1997; 272: 30329-30333.
- Ishibashi K, Kuwahara M, Gu Y & al, Cloning and functional expression of a new aquaporin (AQP-9) abundantly expressed in the peripheral leukocytes permeable to water, but not to glycerol. Biochem Biophys Res Commun, 1998; 244: 268-274.
- Preston GM, Smith BL, Zeidel ML & al, Mutations in aquaporin-1 in phenotypically normal humans without functional CHIP water channels. Science, 1994; 265: 1585-1587.
- Ma T, Yang B, Gillespie A & al, Severely impaired urinary concentrating ability in transgenic mice lacking aquaporin-1 water channels. J Biol Chem, 1998; 273: 4296-4299.
- Oksche A & Rosenthal W, The molecular basis of nephrogenic diabetes insipidus J Molec Med, 1998; 76: 326-337.
- Deen PM, Verdijk MA & Knoers NV, Requirement of human renal water channel aquaporin-2 for vasopressin-dependent concentration of urine. Science, 1994; 264: 92-95.
- DiGiovanni SR, Nielsen S, Christensen El & Knepper MA, Regulation of collecting duct water channel expression by vasopressin in Brattleboro rat. Proc Natl Acad Sci (USA), 1994; 91: 8984-8988.
- Marples DS, Christensen S, Christensen El & al, Lithium-inducted downregulation of aquaporin-2 water channel expression in rat kidney medulla. J Clin Invest, 1995; 95: 1828-1845.
- Nielsen S, Terris J, Anderson D & al, Congestive heart failure in rats is associated with increased expression and targeting of aquaporin-2 water channel in collecting duct. Proc Natl Acad Sci (USA), 1997; 94: 5450-5455.
- Xu DL, Martin PY, Ohara M & al, Upregulation of aquaporon-2 water channel expression in chronic heart failure rat. J Clin Invest, 1997; 99: 1500-1505.
- Fujita N, Ishikawa SE, Sasaki S & al, Role of water channel AQP-CD in water retention is SIADH and cirrhotic rats. Am J Physiol, 1995; 269: F926-F931.
- Apostol E, Ecelbarger CA, Terris J & al, Reduced renal medullary water channel expression in puromycin aminonucleoside-induced nephrotic syndrome, J am Soc Nephrol, 1997; 8: 15-24.